
| ����\�� | ��A | ��A | ��A | ��A | ��A | ��A | ����A | 0 |
| 1 | �� | |||||||
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� |
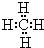 ��д���û��������ĵ��ʷ����û���Ӧ�Ļ�ѧ����ʽ��CH4+2Cl2 $\frac{\underline{\;һ������\;}}{\;}$C+4HCl��
��д���û��������ĵ��ʷ����û���Ӧ�Ļ�ѧ����ʽ��CH4+2Cl2 $\frac{\underline{\;һ������\;}}{\;}$C+4HCl������ ��Ԫ���������ڱ��е�λ�ã���֪��ΪH����ΪC����ΪN����ΪO����ΪNa����ΪAl����ΪSi����ΪCl��
��1��ͬ���ڴ�����ԭ�Ӱ뾶��С��ͬ������ϵ���ԭ�Ӱ뾶������
��2���ɢ١�����Ԫ����ɣ��Ңٵ�����������ߵķ���ΪCH4��CH4��̼ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ�
��������鷢���û���Ӧ����������ǿ�����ԣ��ʷ�Ӧ����̼���Ȼ��⣻
��3��Ԫ�آ۵����������ΪN2O5��Ԫ�آݵ���������ΪNaOH�����߷�Ӧ������������ˮ��
��� �⣺��Ԫ���������ڱ��е�λ�ã���֪��ΪH����ΪC����ΪN����ΪO����ΪNa����ΪAl����ΪSi����ΪCl��
��1��ͬ���ڴ�����ԭ�Ӱ뾶��С��ͬ������ϵ���ԭ�Ӱ뾶������ԭ�Ӱ뾶��Na��Al��C��
�ʴ�Ϊ��Na��Al��C��
��2���ɢ١�����Ԫ����ɣ��Ңٵ�����������ߵķ���ΪCH4��CH4��̼ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ�
��2���ɢ١�����Ԫ����ɣ��Ңٵ�����������ߵķ���ΪCH4��CH4��̼ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ��������ʽΪ�� ��
��
������ǿ�����ԣ�����鷢���û���Ӧ��������̼���Ȼ��⣬��Ӧ����ʽ��CH4+2Cl2 $\frac{\underline{\;һ������\;}}{\;}$C+4HCl��
�ʴ�Ϊ�� ��CH4+2Cl2 $\frac{\underline{\;һ������\;}}{\;}$C+4HCl��
��CH4+2Cl2 $\frac{\underline{\;һ������\;}}{\;}$C+4HCl��
��3��Ԫ�آ۵����������ΪN2O5��Ԫ�آݵ���������ΪNaOH�����߷�Ӧ������������ˮ����Ӧ���ӷ���ʽΪ��N2O5+2OH-�T2NO3-+H2O���ʴ�Ϊ��N2O5+2OH-�T2NO3-+H2O��
���� ���⿼��ṹ����λ�ù�ϵ���뾶�Ƚϡ����û�ѧ������д�ȣ��Ѷ��еȣ��������Ԫ�����ڱ���ȷ��Ԫ�������ǹؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ƻ�� | B�� | ��� | C�� | �ײ� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪25��ʱ����������ʵĵ���ƽ�ⳣ�����������ʾ��
��֪25��ʱ����������ʵĵ���ƽ�ⳣ�����������ʾ��| ��ѧʽ | CH3COOH | H2CO3 | HClO | |
| ����ƽ �ⳣ�� | Ka=1.8��10-5 | Ka1=4.3��10-7 | Ka2=5.6��10-11 | Ka=3.0��10-8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��̼��ĥ�ɷ�ĩ���Լӿ췴Ӧ���� | |
| B�� | �����¶�һ����Լӿ췴Ӧ���� | |
| C�� | �����������ʱ�������г���N2����Ӧ���ʲ��� | |
| D�� | ����̼�������Լӿ췴Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | -2 | B�� | +2 | C�� | +4 | D�� | +6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��д�Ȼ�ѧ����ʽʱ��ֻҪ�ڻ�ѧ����ʽ���Ҷ�д�������ķ��ź���ֵ���� | |
| B�� | �����ڼ��Ȼ��ȼ�����½��еķ�Ӧ�������ȷ�Ӧ | |
| C�� | ������������ȼ�յ��Ȼ�ѧ����ʽ��2H2��g��+O2��g���T2H2O��l����H=-483.6 kJ | |
| D�� | ������Ӧ���ų������������Ļ�ѧ����ʽ�����Ȼ�ѧ����ʽ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����¯ | B�� | ������ | C�� | ��¯ | D�� | �Ӵ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com