
分析 (1)实际生产中合成氨采取的措施是20Mpa~50Mpa、500℃的高温、铁触媒作催化剂;
实际生产中合成SO3采取的措施是常压、400℃~500℃的高温、V2O5作催化剂;
(2)将生成的氨液化并及时从体系中分离出来,减少生成物浓度,平衡正向进行,提高原料的转化率;
合成SO3的过程中,由于二氧化硫的转化率已经很高,分离出SO3对二氧化硫的转化率基本无影响;
(3)依据化学平衡三段式求出各物质的浓度,再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算.
解答 解:(1)实际生产中合成氨采取的措施是20Mpa~50Mpa、500℃的高温、铁触媒作催化剂;
实际生产中合成SO3采取的措施是常压、400℃~500℃的高温、V2O5作催化剂;
故答案为:20Mpa~50Mpa、500℃的高温、铁触媒作催化剂;常压、400℃~500℃的高温、V2O5作催化剂;
(2)将生成的氨液化并及时从体系中分离出来,减少生成物浓度,平衡正向进行,提高原料的转化率;
合成SO3的过程中,由于二氧化硫的转化率已经很高,分离出SO3对二氧化硫的转化率基本无影响,故合成SO3的过程中,则不需要分离出SO3,
故答案为:减少生成物浓度,平衡正向进行,提高原料的转化率;二氧化硫的转化率已经很高,分离出SO3对二氧化硫的转化率基本无影响;
(3)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)?2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol•L-1,则
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 0.05 0.03 0
变化量(mol/L) 0.04 0.02 0.04
平衡量(mol/L)0.01 0.01 0.04
平衡常数=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$=$\frac{0.0{4}^{2}}{0.0{1}^{2}×0.01}$=1.6×103;
故答案为:1.6×103.
点评 本题考查工业合成氨和合成SO3的相关知识,以及平衡常数的相关计算,难度中等.要注意基础知识的积累与比较.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
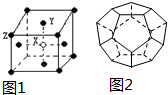 (1)下列4种物质熔点沸点由高到低排列为①>④>③>②(填序号)
(1)下列4种物质熔点沸点由高到低排列为①>④>③>②(填序号) .其最高价氧化物对应的水化物的化学式是H2SO4.
.其最高价氧化物对应的水化物的化学式是H2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液 | B. | KNO3溶液 | C. | 稀醋酸 | D. | Na2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④ | B. | ②④ | C. | ①③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:O2-<F-<Na+<Li+ | B. | 第一电离能:He<Ne<Ar | ||
| C. | 分子中的键角:CH4>H2O>CO2 | D. | 共价键的键能:C-C<C=C<C≡C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可与钠反应 | |
| B. | 其同类同分异构体共4种 | |
| C. | 其同类同分异构体共6种(包括其本身) | |
| D. | 完全燃烧时耗氧的质量比本身的质量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com