
常温下,下列各组离子在指定溶液中一定不能大量共存的是( )
①pH = 0的溶液中:Na+、C2O42-、MnO4-、SO42-
②pH=12的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离出的H+浓度c(H+)水=10-12mol·L-1的溶液中:Na+、Cl-、CO32-、NO3-、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使甲基橙变红的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、Cl-、S2-
A.②④ B.①③⑤ C.①⑤⑥ D.①④⑤
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:2017届湖北省高三上学期开学考试化学试卷(解析版) 题型:选择题
用括号内试剂除去下列各物质中的少量杂质,不正确的是( )
A、乙烯中的二氧化硫(氢氧化钠溶液)
B、乙酸乙酯中的乙酸(饱和Na2CO3溶液)
C、乙烷中的乙烯(Br2水)
D、苯中的苯酚(Br2水)
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期8月月考化学试卷(解析版) 题型:选择题
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρ g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A.ρ=(17V+22400)/(22.4+22.4V) B.ω=17c/(1000ρ)
C.ω=17V/(17V+22400) D.c=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上学期开学测化学试卷(解析版) 题型:填空题
易混易错题组:离子方程式的书写
(1)量变引起离子方程式的变化
将少量NaHSO4溶液滴加到Ba(OH)2溶液中,当恰好沉淀时,反应的离子方程式为______________。
向Ca(HCO3)2溶液中滴加过量NaOH溶液,反应的离子方程式__________________。
(学法题)书写此类离子方程式的关键是,抓住 量物质。
(2)反应顺序引起的变化
向NH4HCO3溶液中,滴加过量的NaOH溶液,反应的离子方程式为______ 。
在FeI2溶液中,滴加少量稀硝酸。该反应的离子方程式是: 。
(学法题)书写此类离子方程式的关键是,抓住反应物中离子的 顺序。
(3)反应介质的影响
①在酸性条件下,向含铬废水中加入FeSO4,可将Cr2O72-还原为Cr3+,该过程的离子反应方程式为 。
②在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,离子方程式为___________________________。
③在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,离子方程式是_______________。
④对比②和③实验所得的结果,将I2、ClO-、SO42-按氧化性由强到弱的顺序排列为___________。
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上学期开学测化学试卷(解析版) 题型:选择题
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+):n(Cl-)可能为7:3
C.若反应中转移的电子为n mol,则0.15<n<0.25
D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第二次月考化学试卷(解析版) 题型:推断题
有机物G是一种医药中间体,可通过如下图所示路线合成。A是石油化工的重要产品且分子中所有原子在同一平面上,H的分子式是C7H8。

请回答以下问题:
(1)A的电子式是 ;
(2)C→D的反应类型是 ;
(3)在一定条件下,两个E分子发生分子间脱水生成一种环状酯,写出该环状酯的结构简式 ;
(4)G与足量的氢氧化钠溶液反应的化学方程式是 ;
(5)满足以下条件的F的同分异构体(不含F)共有 种;①能与氯化铁溶液发生显色反应②可以发生水解反应,其中核磁共振氢谱吸收峰最少的同分异构体的结构简式为 。(只写一种)
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第二次月考化学试卷(解析版) 题型:选择题
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为
A.7:1 B.7:2 C.7:3 D.7:4
查看答案和解析>>
科目:高中化学 来源:2017届湖北省沙市高三上学期第三次考试化学试卷(解析版) 题型:实验题
某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。

(1)稀硫酸应放在 中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关将仪器中的空气排尽后,再关闭开关 、打开开关 ,就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由 。
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是 。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
i滴定过程中发生反应的离子方程式为
ii滴定终点的现象是
iii通过实验数据计算的该产品纯度为 (用字母a,c表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是 (填字母代号 )。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴无气泡,滴定结束有气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上学期摸底考试理综化学试卷(解析版) 题型:填空题
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(KJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背 ,B元素位于周期表五个区域中的 区。
1s 2s 2p 3s 3p

②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①以体心立方堆积形成的金属铁中,其原子的配位数为 。
②写出一种与CN-互为等电子体的单质的电子式 。
③六氰合亚铁离子[Fe(CN)6]4-中不存在 。
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
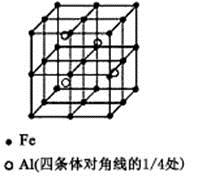
(3)一种Al-Fe合金的立体晶胞如右图所示。请据此回答下列问题:
①确定该合金的化学式 。
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com