
| A. | ①③⑥ | B. | ③④⑤⑥ | C. | ①②③⑥ | D. | ③⑤⑥ |
分析 根据共价键单键中含有一个σ键,双键中含有一个σ键和一个π键,三键中有一个σ键和两个π键,所以含有两个π键说明分子中含有一个三键或两个双键,据此分析.
解答 解:①H-C≡N的分子中有C≡N,所以含有两个π键;
②H2O分子中没有双键,所以不含有π键;
③N2 的分子中有N≡N,所以含有两个π键;
④H2O2分子中没有双键,所以不含有π键;
⑤C2H4 的分子中只有一个C=C,所以含有一个π键;
⑥CH≡CH 分子中有C≡C,所以含有两个π键;
所以分子中含有两个π键的是①③⑥;
故选A.
点评 本题考查了共价键的类型,根据双键中含有一个σ键和一个π键,三键中有一个σ键和两个π键分析,题目比较简单.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg+2H2O═Mg(OH)2+H2↑ | B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | ||
| C. | 2F2+2H2O═O2+4HF | D. | 3NO2+H2O═2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.80g | B. | 3.25g | C. | 3.36g | D. | 4.48g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
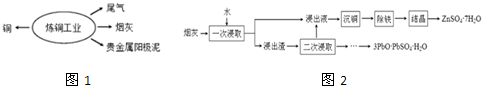
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;Y离子的电子式为Al3+.
;Y离子的电子式为Al3+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 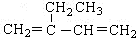 :2-乙基-1,3-丁二烯 :2-乙基-1,3-丁二烯 | B. | CH3CH2CH2CH2OH:丁醇 | ||
| C. | 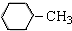 :甲苯 :甲苯 | D. | HOCH2CH2CH2OH:1,3-二丙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com