
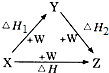
| A. | ①②③ | B. | ②③ | C. | ②④ | D. | ①③④ |
分析 由图可知,图示既是盖斯定律的应用,也是物质之间相互转化,符合转化关系的有变价物质的氧化反应、有机物之间的反应、两性物质的转化以及多元酸对应的盐类之间的反应等,
①X为S,Y为SO2,则W为O2;
②X为AlCl3,Y为Al(OH)3,则X为NaOH;
③X为H2S,Y为S,则W为O2;
④X为Fe,Y为FeCl2,则W为Cl2,以此来解答.
解答 解:①S与氧气不能反应生成SO3,不符合X、Z的转化,不符合;
②发生AlCl3$\stackrel{NaOH}{→}$Al(OH)3 $\stackrel{NaOH}{→}$NaAlO2的转化,AlCl3$\stackrel{NaOH}{→}$NaAlO2的转化,符合;
③发生H2S$\stackrel{O_{2}}{→}$S$\stackrel{O_{2}}{→}$SO2,H2S$\stackrel{O_{2}}{→}$SO2的转化,符合;
④Fe与氯气不能直接转化为FeCl2,不符合,
故选B.
点评 本题考查无机物的推断及物质的性质,为高频考点,综合考查元素化合物知识,把握物质的性质、相互转化及盖斯定律的应用为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 该反应为吸热反应 | B. | CO2分子中的化学键为非极性键 | ||
| C. | HCHO分子中含δ键又含π键 | D. | 每生成1.8gH2O消耗2.24LO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
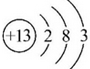
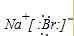 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除②以外 | B. | 除④以外 | C. | 除⑤以外 | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
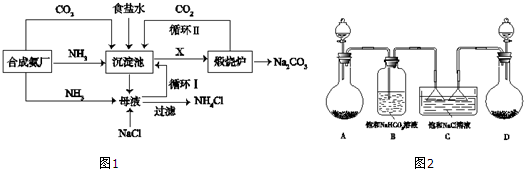
 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物光合作用:光能→生物质能 | B. | 太阳能热水器:太阳能→电能 | ||
| C. | 石灰石高温分解:热能→化学能 | D. | 铅蓄电池:化学能→电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,热能转变为化学能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com