
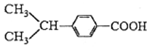
 与
与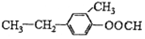
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
分析 同分异构体是指分子式相同,但结构不同的化合物,同分异构体包含碳链异构、官能团异构、位置异构等,以此来解答.
解答 解:①蔗糖和麦芽糖的分子式都为C12H22O11,蔗糖水解生成葡萄糖和果糖,麦芽糖水解生成葡萄糖,二者结构不同,互为同分异构体,故正确;
②甲醚(C2H6O)与乙醇的分子式都为C2H6O,甲醚含有醚键,乙醇含有-OH,二者结构不同,互为同分异构体,故正确;
③淀粉和纤维素的分子式为(C6H10O5)n,聚合度n不同,分子式不同,所以不是同分异构体,故错误;
④ 与
与 的分子式相同,含有的官能团不同,则结构式不同,所以互为同分异构体,故正确;
的分子式相同,含有的官能团不同,则结构式不同,所以互为同分异构体,故正确;
故选C.
点评 本题考查了同分异构体的判断、有机物的结构,难度不大,注意对同分异构体定义的理解,注意同分异构体、同素异形体、同系物、同位素的区别.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:选择题
| A. | Q=483.6 | B. | Q>483.6 | C. | Q<483.6 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 原NH4HCO3溶液中:c(OH-)=c(H+)-c(CO32-)-c(NH3•H2O)+c(H2CO3) | |
| C. | 析出晶体后的溶液中:c(Cl-)=c(NH4+),c(Na+)=c(HCO3-) | |
| D. | 析出晶体后的溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 收集方法是向下排空气法 | |
| B. | 将湿润的蓝色石蕊试纸放在试管口处验满 | |
| C. | 试管口的棉花可防止氨气与空气形成对流,利于收集氨气 | |
| D. | 实验结束后将蘸有稀硫酸的棉花放在导管口吸收剩余氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
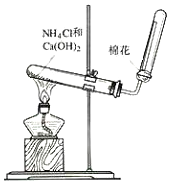
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
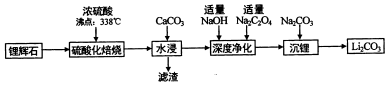
| 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 显蓝色的淀粉溶液中通入足量的SO2后变成无色溶液:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀:Ca2++HCO3-+OHˉ═CaCO3↓+H2O | |
| D. | 盛放烧碱溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com