
ЁОЬтФПЁПЂёЁЂЪЕбщЪввЊХфжЦЮяжЪЕФСПХЈЖШЮЊ0.1 mol/LЕФNaOHШмвК480 mL
ЃЈ1ЃЉЬюБэЃК
ХфжЦЪБгІГЦСПNaOHЕФжЪСП/g | вбИјвЧЦї | ХфжЦЪБГ§вбИјвЧЦїЭтЛЙашвЊЕФЦфЫћвЧЦї |
__________ | ЩеБЁЂвЉГзЁЂЭаХЬЬьЦН | ____________________________ |
ЃЈ2ЃЉШєвЊМЦЫуИУШмвКШмжЪЕФжЪСПЗжЪ§ЃЌЛЙашвЊЕФвЛИіЬѕМўЪЧ______________(гУЮФзжЫЕУїЃЉЁЃ
ЃЈ3ЃЉЯТСаВйзїЖдХфжЦЕФNaOHШмвКХЈЖШгаЦЋИпгАЯьЕФЪЧ_________________ЃЈЬюзжФИЃЉ
AЃЎГЦСПNaOHЙЬЬхЪБЃЌТЖжУдкПеЦјЕФЪБМфЙ§ГЄ
BЃЎбЁгУЕФШнСПЦПФкгаЩйСПЕФеєСѓЫЎ
CЃЎдкЩеБжаШмНтNaOHКѓЃЌСЂМДНЋЫљЕУШмвКзЂШыШнСПЦПжа
DЃЎдкЖЈШнЪБбіЪгШнСПЦППЬЖШЯп
ЂђЁЂЪЕбщЪвгУЯТЭММИИіЪЕбщзАжУЃЌПЩПьЫйжЦШЁЩйСПЦјЬхЃЌВЂНјааЯрЙиаджЪЪЕбщЁЃ

ЃЈ1ЃЉШє AЮЊ30%H2O2ШмвКЃЌBЮЊMnO2 ЃЌCЪЂгаЧтСђЫсЃЈH2SЃЉБЅКЭШмвКЃЌа§ПЊEКѓЃЌCжаГіЯжЧГЛЦЩЋЛызЧЕФЯжЯѓЃЌаДГіCжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЃК______________________________________ЁЃ
ЃЈ2ЃЉШєAжазАгаХЈбЮЫсЃЌBжазАгаЙЬЬхKMnO4 ЃЌCжаЪЂгаKIЕэЗлШмвКЃЌа§ПЊEКѓЃЌBжаГіЯжЛЦТЬЩЋЦјЬхЁЃвбжЊ1 mol KMnO4ЗЂЩњЗДгІЪБзЊвЦ5molЕчзгЁЃдђBжаЗЂЩњЗДгІЕФРызгЗНГЬЪНЪЧЃК_______ЃЛCжаЕФЯжЯѓЪЧЃК___________ЁЃ
ЁОД№АИЁП2.0 500 mLШнСПЦПЁЂВЃСЇАєЁЂНКЭЗЕЮЙмЁЂСПЭВ ИУШмвКЕФУмЖШ C 2H2S + O2 = SЁ§+ 2H2O 2MnO4-+16H+ + 10Cl- =2Mn2+ +5Cl2Ёќ+8H2O ЮоЩЋШмвКБфЮЊРЖЩЋ
ЁОНтЮіЁП
ЂёЁЂЃЈ1ЃЉЪЕбщЪввЊХфжЦЮяжЪЕФСПХЈЖШЮЊ0.1 mol/LЕФNaOHШмвК480 mLЃЌашвЊбЁгУ500mL ЕФШнСПЦПНјааХфжУЃЌХфжЦ500mL 0.1mol/LЕФNaOHШмвКашвЊЧтбѕЛЏФЦЙЬЬхЕФжЪСПЪЧ0.5LЁС0.1mol/LЁС40g/mol=2.0gЃЛШмНтКЭзЊвЦвКЬхЪБЖМашвЊВЃСЇАєЃЌЖЈШнЛЙашвЊНКЭЗЕЮЙмЃЌШнСПЦПдђашвЊ500mlЕФЃЌСэЭтЛЙгаСПШЁеєСѓЫЎЕФСПЭВЃЛ
ЃЈ2ЃЉШмжЪЕФжЪСПЗжЪ§=ШмжЪЕФжЪСП/ШмвКЕФжЪСПЃЌЬтжавбжЊШмжЪЕФжЪСПЗжЪ§ЃЌКЭШмвКЕФЬхЛ§ЃЌвђДЫЛЙашвЊжЊЕРШмвКЕФУмЖШЃЛ
ЃЈ3ЃЉAЃЎГЦСПNaOHЙЬЬхЪБЃЌТЖжУдкПеЦјЕФЪБМфЙ§ГЄЃЌNaOHЮќЪеПеЦјжаЕФЫЎКЭЖўбѕЛЏЬМЖјБфжЪЃЌЕМжТХЈЖШЦЋЕзЃЛ
BЃЎбЁгУЕФШнСПЦПФкгаЩйСПЕФеєСѓЫЎЃЌВЛгАЯьХЈЖШЃЛ
CЃЎдкЩеБжаШмНтNaOHКѓЃЌСЂМДНЋЫљЕУШмвКзЂШыШнСПЦПжаЃЌЕМжТЖЈШнЪБЬхЛ§ЦЋаЁЃЌвђДЫЕМжТХЈЖШЦЋДѓЃЛ
DЃЎдкЖЈШнЪБбіЪгШнСПЦППЬЖШЯпЃЌЕМжТЖЈШнЬхЛ§ЦЋДѓЃЌвђДЫЕМжТШмвКХЈЖШЦЋаЁЃЛ
злЩЯЫљЪіЃЌБОЬте§ШЗД№АИЮЊCЃЛ
ЂђЁЂЃЈ1ЃЉЙ§бѕЛЏЧтдкЖўбѕЛЏУЬЕФДпЛЏзїгУЯТЩњГЩбѕЦјЃЌбѕЦјНјШыCжагыСђЛЏЧтЗЂЩњбѕЛЏЛЙдЗДгІЩњГЩСђЕЅжЪЃЌЗДгІЗНГЬЪНЮЊ2H2S + O2 = SЁ§+ 2H2OЃЛ
ЃЈ2ЃЉХЈбЮЫсгыИпУЬЫсМиЗДгІЩњГЩТШЦјЃЌвбжЊ1 mol KMnO4ЗЂЩњЗДгІЪБзЊвЦ5molЕчзгЃЌМДMnДг+7МлЯТНЕЕН+2МлЃЌРызгЗДгІЗНГЬЪНЮЊЃК2MnO4-+16H+ + 10Cl- =2Mn2+ +5Cl2Ёќ+8H2OЃЌТШЦјгыCжаЕФЕтЛЏМиЗДгІЩњГЩЕтЕЅжЪЃЌЕтЕЅжЪПЩЪЙЕэЗлШмвКБфРЖЃЌвђДЫCжаЕФЯжЯѓЪЧЮоЩЋШмвКБфРЖЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮЊНЋЛьгаK2SO4ЁЂMgSO4ЕФKNO3ЙЬЬхЬсДП,ВЂжЦЕУKNO3ШмвК,ФГбЇЩњЩшМЦСЫШчЯТЪЕбщЗНАИ:

(1).ВйзїЂйЮЊ__________ЁЃ
(2).ВйзїЂк~ЂмЫљМгЪдМСЕФШмжЪвРДЮЮЊ__________ЁЃ
(3).ШчКЮХаЖЯSO42-вбГ§ОЁ?__________ЁЃ
(4).ЪЕбщЙ§ГЬжаВњЩњЕФЖржжГСЕэ__________(ЬюЁАашвЊЁБЛђЁАВЛашвЊЁБ)ЖрДЮЙ§ТЫ,ЦфРэгЩЪЧ__________ЁЃ
(5).ИУЭЌбЇЕФЪЕбщЩшМЦЗНАИЪЧЗёбЯУм?__________(ЬюЁАбЯУмЁБЛђЁАВЛбЯУмЁБ),ЧыЫЕУїРэгЩ:__________.
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчБэЗжРре§ШЗЕФЪЧЃЈ ЃЉ
бЁЯю | ЕЅжЪ | Ыс | Мю | НКЬх |
A | ЫЎвј | ЯѕЫс | ДПМю | ЕААзжЪШмвК |
B | фхЫЎ | СзЫс | ЩеМю | бЬ |
C | C60 | ДзЫс | ЪьЪЏЛв | Юэ |
D | Гєбѕ | ЬМЫс | ЧтбѕЛЏЭ | ЧтбѕЛЏЬњГСЕэ |
A.AB.BC.CD.D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаРызгЗНГЬЪНБэДяе§ШЗЕФЪЧ
A. гУЖшадЕчМЋЕчНтТШЛЏУОШмвКЃК2Cl-+2H2O![]() Cl2Ёќ+H2Ёќ+OH-
Cl2Ёќ+H2Ёќ+OH-
B. ЬМЫсЧтФЦШмвКгыЙ§СПГЮЧхЪЏЛвЗДгІЃКHCO3-+Ca2++OH-= CaCO3Ё§+ H2O
C. NaHS04ШмвКжаЕЮШыBa(OH)2ШмвКжСS042-ЭъШЋГСЕэЃК2H++S042-+Ba2++ OH-= BaS04Ё§+2 H2O
D. ЯђУїЗЏШмвКжаЕЮМгЙ§СПАБЫЎЃКAl3++4NH3![]() H2O=Al02-+4NH4++2H2O
H2O=Al02-+4NH4++2H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСђЕЅжЪМАЦфЛЏКЯЮядкЛЏЙЄЩњВњЁЂЮлЫЎДІРэЕШСьгђгІгУЙуЗКЁЃ
ЃЈ1ЃЉУКжЦЕУЕФЛЏЙЄдСЯЦјжаКЌгаєЪЛљСђ(O=C=S)ЃЌИУЮяжЪПЩзЊЛЏЮЊH2SЃЌжївЊЗДгІШчЯТЃК
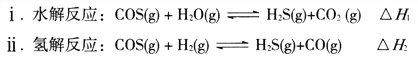
вбжЊЗДгІжаЯрЙиЕФЛЏбЇМќМќФмЪ§ОнШчЯТБэЃК
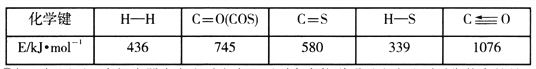
ЂйвЛЖЈЬѕМўЯТЃЌУмБеШнЦїжаЗЂЩњЗДгІiЃЌЦфжаCOS(g)ЕФЦНКтзЊЛЏТЪ(![]() )гыЮТЖШ(T)ЕФЙиЯЕШчЭМЫљЪОЁЃдђAЁЂBЁЂCШ§ЕуЖдгІЕФзДЬЌжаЃЌv(COS)=v(H2S)ЕФЪЧ____________ЁЃ(ЬюБъКХ)
)гыЮТЖШ(T)ЕФЙиЯЕШчЭМЫљЪОЁЃдђAЁЂBЁЂCШ§ЕуЖдгІЕФзДЬЌжаЃЌv(COS)=v(H2S)ЕФЪЧ____________ЁЃ(ЬюБъКХ)
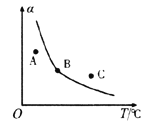
ЂкЗДгІiiЕФе§ЁЂФцЗДгІЕФЦНКтГЃЪ§(K)гыЮТЖШ(T)ЕФЙиЯЕШчЭМЫљЪОЃЌЦфжаБэЪОФцЗДгІЕФЦНКтГЃЪ§(KФц)ЕФЪЧ__________(ЬюЁАAЁБЛђЁАBЁБ)ЁЃT1ЁцЪБЃЌЯђШнЛ§ЮЊ10 LЕФКуШнУмБеШнЦїжаГфШы2 mol COS(g)КЭ1 mol H2(g)ЃЌЗЂЩњЗДгІiiЃЌCOSЕФЦНКтзЊЛЏТЪЮЊ_____________ЁЃ
ЃЈ2ЃЉЙ§ЖўСђЫсЪЧвЛжжЧПбѕЛЏадЫсЃЌЦфНсЙЙЪНЮЊ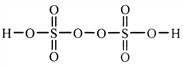
ЂйдкAg+ДпЛЏзїгУЯТЃЌS2O82-ФмгыMn2+дкЫЎШмвКжаЗЂЩњЗДгІЩњГЩSO42-КЭMnO4-ЃЌИУЗДгІЕФРызгЗНГЬЪНЮЊ________________________ЁЃ
ЂкЙЄвЕЩЯПЩгУЖшадЕчМЋЕчНтСђЫсКЭСђЫсяЇЛьКЯШмвКЕФЗНЗЈжЦБИЙ§ЖўСђЫсяЇЁЃзмЗДгІЕФРызгЗНГЬЪНЮЊ________________________________ЁЃ
ЃЈ3ЃЉNaHSПЩгУгкЮлЫЎДІРэЕФГСЕэМСЁЃвбжЊЃК25ЁцЪБЃЌЗДгІHg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)ЕФЦНКтГЃЪ§K=1.75ЁС1038ЃЌH2SЕФЕчРыЦНКтГЃЪ§Ka1=1.0ЁС10-7ЃЌKa2=7.0ЁС10-15ЁЃ
HgS(s)+H+(aq)ЕФЦНКтГЃЪ§K=1.75ЁС1038ЃЌH2SЕФЕчРыЦНКтГЃЪ§Ka1=1.0ЁС10-7ЃЌKa2=7.0ЁС10-15ЁЃ
ЂйNaHSЕФЕчзгЪНЮЊ____________________ЁЃЂкKsp(HgS)=_____________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкФГЮТЖШЪБЃЌНЋn mol/LАБЫЎЕЮШы10mL 1.0mol/LбЮЫсжаЃЌШмвКpHКЭЮТЖШЫцМгШыАБЫЎЬхЛ§БфЛЏЧњЯпШчЭМЫљЪОЃЌгаЙиЫЕЗЈе§ШЗЕФЪЧЃЈЁЁ ЁЁЃЉ
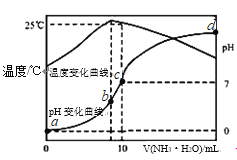
A. aЕуKw=1.0ЁС10Љ14 mol 2![]() LЉ2
LЉ2
B. ЫЎЕФЕчРыГЬЖШЃКbЃОcЃОaЃОd
C. bЕуЃКcЃЈNH4+ЃЉЃОcЃЈClЉЃЉЃОcЃЈH+ЃЉЃОcЃЈOHЉЃЉ
D. 25Ёц ЪБNH3ЁЄH2OЕФЕчРыГЃЪ§ЮЊ![]() mol
mol![]() L-1ЃЈгУnБэЪОЃЉ
L-1ЃЈгУnБэЪОЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊБНЗжзгЮЊЦНУце§СљБпаЮЕФНсЙЙЃЌЯТСаЫЕЗЈжаДэЮѓЕФЪЧ(ЁЁЁЁ)
A. БНЗжзгжаЬМдзгМфаЮГЩЕФЬМЬММќЭъШЋЯрЭЌ
B. БНЗжзгжааЮГЩЙВМлМќЕФМаНЧЖМЪЧ120Ёу
C. БНЗжзгжа6ИіЬМдзгЮЛгкЭЌвЛЦНУцФк
D. БНЗжзгжаЕФЬМдзггыЧтдзгВЛдкЭЌвЛЦНУцФк
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкЮЂЩњЮязїгУЯТЕчНтгаЛњЗЯЫЎ(КЌCH3COOH)ЃЌПЩЛёЕУ[НрФмдДH2ЁЃЦфдРэШчЭМЫљЪОЁЃЯТСагаЙиЫЕЗЈВЛе§ШЗЕФЪЧ

A. ЕчдДBМЋЮЊИКМЋ
B. ЭЈЕчКѓЃЌШєга0.1 mol H2ЩњГЩЃЌдђзЊвЦ0. 2 molЕчзг
C. ЭЈЕчКѓЃЌH+ЭЈЙ§жЪзгНЛЛЛФЄЯђгввЦЖЏЃЌзюжегвВрШмвКpHМѕаЁ
D. гыЕчдДAМЋЯрСЌЕФЖшадЕчМЋЩЯЗЂЩњЕФЗДгІЮЊCH3COOH-8e-+2H2O=2CO2Ёќ+ 8H+
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђNa2CO3ЁЂNaHCO3ЛьКЯШмвКжаж№ЕЮМгШыЯЁбЮЫсЃЌЩњГЩЦјЬхЕФСПЫцбЮЫсМгШыСПЕФБфЛЏЙиЯЕШчЭМЫљЪОЃЌдђЯТСаРызгзщдкЖдгІЕФШмвКжавЛЖЈФмДѓСПЙВДцЕФЪЧ(вбжЊЯѕЫсПЩНЋFe2ЃЋбѕЛЏ)( )
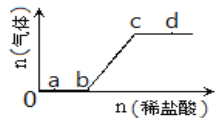
A. aЕуЖдгІЕФШмвКжаЃКNa+ЁЂOH-ЁЂSO42-ЁЂNO3- B. bЕуЖдгІЕФШмвКжаЃКK+ЁЂAg+ЁЂMnO4-ЁЂNO3-
C. cЕуЖдгІЕФШмвКжаЃКFe2+ЁЂCa2+ЁЂNO3-ЁЂCl- D. dЕуЖдгІЕФШмвКжаЃКK+ЁЂFe2+ЁЂNO3-ЁЂSO42-
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com