
分析 ①蒸发需要蒸发皿;
②依据n=cV计算物质的量,利用n=$\frac{m}{M}$计算质量即可,依据配制100mL一定物质的量浓度的溶液选择容量瓶.
解答 解:①蒸发需要:蒸发皿、玻璃棒和酒精灯,瓷质仪器的名称为蒸发皿,
故答案为:蒸发皿;
②100mL 1mol•L-1的NaCl溶液,氯化钠的物质的量为0.1L×1mol/L=0.1mol,质量为:0.1mol×58.5g/mol=5.85g,由于天平精确度为0.1g,故需要称量5.9,实验中需要用100mL 1mol•L-1的NaCl溶液,故选择100mL容量瓶,
故答案为:5.9;100mL容量瓶.
点评 本题主要考查的是实验中常见仪器的度数方法、实验室中常见仪器的使用、物质的量的有关计算,题目难度不大.


科目:高中化学 来源: 题型:解答题
 NH3•H2O+H+.
NH3•H2O+H+.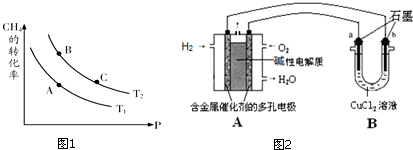
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L的纯碱溶液:c(CO32-)=0.01mol/L | |
| B. | 在Na2S稀溶液中,c(H+)=c(OH-)+2c(H2S)+c(HS-) | |
| C. | CaCO3难溶于稀硫酸,也难溶于醋酸 | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.1mol/L的①CH3COOH ②NH4Cl ③H2SO4三种溶液中,由水电离出的c(H+):①>③>② | |
| B. | 常温下,pH=2与pH=3的CH3COOH溶液,前者的c(CH3COOH)是后者的10倍 | |
| C. | 任意稀盐酸中c(H+)的精确计算式可以表示为c(H+)=c(Cl-)+Kw/c(OH-) | |
| D. | 同c(NH4+)的溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4溶液,物质的量浓度最大的是③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 与
与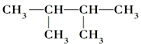
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com