

| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
分析 (1)①1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热,据此结合图象分析;
②根据热化学方程式:2SO2(g)+O2(g)?2SO3(g)△H=-196.6KJ•mol-1计算;
③假设1molSO3和0.5molO2完全转化为SO2和O2,与原来的初始量相同,所以两次平衡是等效平衡,即平衡时SO2为0.2mol,SO3为0.8mol;当反应逆向进行时反应热大小不变,符号相反,根据物质的量之比等于热量比求算;
(2)①利用太阳光催化分解水制氢是最节能的,能减少电能、天然气及热能的利用;
②根据v=$\frac{△c}{△t}$计算出v(CH3OH),然后根据速率之比等于化学计量数之比求出v(H2);
③在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理性也不变;
(3)A、由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,升高温度平衡向吸热反应移动;
B、利用三段式计算出平衡时平衡混合物各组分的浓度,代入平衡常数的表达式计算;
C、由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,不利用原料气转化.
解答 解:(1)①燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,所以,硫的物质的量为1mol.由图1可知1molS(s)完全燃烧生成SO2放出的热量为297KJ,所以,硫的燃烧热的热化学方程式为:S(s)+O2(g)?SO2(g)△H=-297 KJ•mol-1;
故答案为:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1;
②由图1可知,参加反应的n(SO2)=1mol-0.2mol=0.8mol,根据热化学方程式:2SO2(g)+O2(g)?2SO3(g)△H=-196.6KJ•mol-1;可知,△H2=0.4△H=
0.4×(-196.6KJ•mol-1)=-78.64KJ•mol-1;
故答案为:-78.64;
③假设1molSO3和0.5molO2完全转化为SO2和O2,则与原来的初始量相同,所以两次平衡是等效平衡,即平衡时SO2为0.2mol,SO3为0.8mol,所以SO3转化了0.2mol,则达到平衡时SO3的转化率为$\frac{0.2mol}{1mol}$×100%=20%;已知2SO2(g)+O2(g)?2SO3(g)△H=-196.6KJ•mol-1,当反应逆向进行时反应热大小不变,符号相反,
所以SO3转化SO2时反应吸热,热量为196.6KJ×$\frac{0.2mol}{2mol}$=19.66KJ;
故答案为:20%;吸收; 19.66;
(2)①A、消耗电能,不是最节能的方法,故A错误;
B、消耗热能,不是减碳的手段,故B错误;
C、利用太阳光催化分解水制氢是最节能的,故C正确;
D、天然气是非再生能源,且不是最节能的方法,故D错误;
故答案为:C;
②由图象可知:v(CH3OH)=$\frac{0.75mol/L-0.5mol/L}{6min}$=$\frac{0.25}{6}$mol/(L•min),v(H2)=3v(CH3OH)=0.125mol/(L•min),
故答案为:0.125mol/(L•min);
③A.由图可知反应中CO2与CH3OH的物质的量浓度之比为1:1时,并未达到平衡状态,故A错误;
B.因气体的质量不变,容器的体积不变,则无论是否达到平衡状态,都存在混合气体的密度不随时间的变化而变化,不能判断是否达到平衡状态,故B错误;
C.3个H-H键断裂的同时有3个C-H键断裂说明该反应达到平衡状态,所以当3个H-H键断裂的同时有4个C-H键断裂时该反应没有达到平衡状态,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故D正确;
故答案为:D.
(3)A、由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,故A正确;
B、对于可逆反应:CO(g)+2H2(g)?CH3OH(g)
开始(mol/L):0.1 0.2 0
变化(mol/L):0.05 0.1 0.05
平衡(mol/L):0.05 0.1 0.05
所以平衡常数k=$\frac{0.05}{0.05×0.{1}^{2}}$=100,故B正确;
C、增大压强,平衡向正反应移动,有利于原料气转化.由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,故升高不利用原料气转化,采取250℃温度,考虑反应速率与催化剂的活性,故C错误;
故选:AB.
点评 本题主要考查了热化学方程式的书写,反应能量的计算、化学反应速率以及平衡状态的判断,化学平衡的有关计算等,题目综合性较强,难度较大,注意知识的积累.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
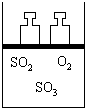 如图所示,将4mol SO2和2mol O2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,试回答:
如图所示,将4mol SO2和2mol O2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定条件下,将1mol N2和1.0mol H2充入容积为10L的恒容密闭容器中合成NH3、N2、H2的物质的量随时间的变化曲线如图所示.
一定条件下,将1mol N2和1.0mol H2充入容积为10L的恒容密闭容器中合成NH3、N2、H2的物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 | |
| B. | Zn具有氧化性和导电性,可用作锌锰干电池的负极材料 | |
| C. | 炭具有强还原性,高温下能将二氧化硅还原为硅 | |
| D. | 二氧化硫具有漂白性,与氯水混合使用效果会更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用到金属钠时,要用镊子取、再用小刀切下所需量,剩余的钠不能放回原试剂瓶中 | |
| B. | 大型中央空调的制冷剂可用液氨 | |
| C. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 | |
| D. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| B. | 碘是人体必需微量元素,国家规定食盐必须加碘.故炒菜时应在菜快出锅时放盐比较好 | |
| C. | 单质硅常用做光导纤维的材料,这与硅的半导体性能有一定关系 | |
| D. | 高压钠灯发出的黄光射程远、透雾能力强,常用做路灯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com