
 ,砷属于p区元素.
,砷属于p区元素.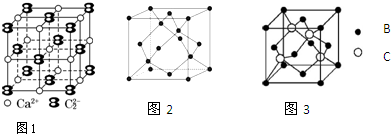
分析 (1)拟卤素如(CN)2、(SCN)2、(OCN)2等与卤素单质结构相似、性质相近.已知(CN)2分子中所有原子都满足8电子稳定结构,C原子形成四个共用电子对、N原子形成三个共用电子对;能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键;
(2)RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,利用半径来分析晶格能相对较大的卤化物;
(3)碳原子的L层有4个电子;s区的外围电子排布为nsx(氦除外),包含第ⅠA、ⅡA族元素,
p区的外围电子排布为ns2npx(包含氦氦元素,氦除外),包含ⅢA~ⅦA族元素与零族元素,
ds区的外围电子排布为nd10(n+1)sx,包含ⅠB、ⅡB元素,
d区的外围电子排布为ndx (n+1)sy,x不等于10,包含ⅢB~ⅦB族元素与第Ⅷ族元素,
f区外围电子排布为(n-2)f1~14 ns1~2,包括镧系和锕系,据此判断;
(4)N与氢元素可形成一种原子个数比为1:1的粒子,其式量为60,则分子式为N4H4,经测定该粒子中有一正四面体构型,活泼金属和活泼非金属元素之间易形成离子键、非金属元素之间易形成共价键,不同非金属元素之间易形成极性共价键,同种非金属元素之间易形成非极性共价键;
(5)根据图知,以最中心钙离子为例,判断钙离子配位数;
(6)A的第一电离能介于镁和硫两元素之间,形成晶体结构可知为硅.
解答 解:(1)拟卤素如(CN)2、(SCN)2、(OCN)2等与卤素单质结构相似、性质相近.已知(CN)2分子中所有原子都满足8电子稳定结构,C原子形成四个共用电子对、N原子形成三个共用电子对,( CN)2结构式为N≡C-C≡N,每个分子中含有4个π键,3个σ键,则其分子中σ键与π键数目之比为3:4;能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键,所以异硫氰酸熔沸点高于硫氰酸,
故答案为:3:4;异硫氰酸分子间可形成氢键,而硫氰酸不能;
(2)RbICl2加热时会分解为晶格能相对大的卤化物A和卤素互化物或卤素单质,氯离子的半径小于碘离子的半径,则RbCl的离子键长小于RbI的离子键长,则RbCl的晶格能较大,则A为RbCl,故答案为:RbCl;
故答案为:RbCl;
(3)碳原子的L层有4个电子,2个在2S上,2个在2P上,且自旋相同,碳的基态原子L层电子轨道表达式为 ,砷原子的外围电子排布为ns2npx
,砷原子的外围电子排布为ns2npx
故答案为: ;p;
;p;
(4)氮原子之间形成非极性键,氮原子和氢原子之间形成极性键,氢原子和氮原子之间形成配位键,
故答案为:ABC;
(5)根据图知,以最中心钙离子为例,CaC2晶体中1个Ca2+周围距离最近的C22-数目为4,故答案为:4;
(6)A、B、C为原子序数依次递增的前四周期的元素,A的第一电离能介于镁和硫两元素之间,A单质晶体的晶胞结构如图2所示分析可知,A为硅形成的晶体,属于原子晶体,
故答案为:原子;
(7)B的价电子排布为(n+1)sn(n+1)pn+2,有三个电子层,外层为6个电子,B为S原子,C位于元素周期表的ds区,其基态原子不存在不成对电子,判断为Zn原子,B与C所形成化合物晶体的化学式为:ZnS,
故答案为:ZnS.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、化学键判断、氢键等知识点,明确物质结构、极性键和非极性键概念区别、原子结构等知识点是解本题关键,注意:配位键属于共价键,氢键属于分子间作用力,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 )
) .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ | |
| D. | 三氯化铁溶液跟过量氨水反应Fe3++3OH-═Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性KMnO4溶液能鉴别CH3CH═CHCH2OH和CH3CH2CH2CHO | |
| B. | 乙酸乙酯能水解,可用于制备肥皂 | |
| C. | 根据核磁共振氢谱不能鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 食用花生油和鸡蛋清都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
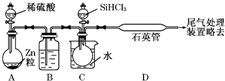 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
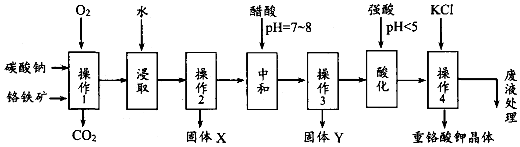
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com