分析:甲、乙、丙是分别由H、C、O、Si、Al、Cu等六种元素中的两种或多种元素组成的化合物.
含化合物甲的矿物是工业上电解法冶炼某种常见金属单质的原料,经检测甲是一种高熔点化合物,能溶于强酸、强碱溶液,结合物质含有的元素,甲为Al
2O
3;
化合物乙是光导纤维的主要成分,乙为SiO
2;
化合物丙为一种呈深蓝色的碱式盐,将34.6g丙隔绝空气加热分解生成24g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96g/L)和水,Y的摩尔质量为1.96g/L×22.4L/mol=44g/mol,结合物质含有的元素,故Y为CO
2,固体X难溶于水,能溶于硫酸,形成蓝色溶液,为硫酸铜溶液,故X为CuO,即丙为碱式碳酸铜,生成的CO
2折合成标准状况下的体积为4.48L,物质的量为
=0.2mol,根据碳元素守恒可知CuCO
3为0.2mol,24gCuO的物质的量为
=0.3mol,根据铜元素守恒Cu(OH)
2为0.3mol-0.2mol=0.1mol,故碱式碳酸铜中n(CuCO
3):n[Cu(OH)
2]=0.2mol:0.1mol=2:1,故该碱式碳酸铜化学式为2CuCO
3?Cu(OH)
2.
解答:解:甲、乙、丙是分别由H、C、O、Si、Al、Cu等六种元素中的两种或多种元素组成的化合物.
含化合物甲的矿物是工业上电解法冶炼某种常见金属单质的原料,经检测甲是一种高熔点化合物,能溶于强酸、强碱溶液,结合物质含有的元素,甲为Al
2O
3;
化合物乙是光导纤维的主要成分,乙为SiO
2;
化合物丙为一种呈深蓝色的碱式盐,将34.6g丙隔绝空气加热分解生成24g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96g/L)和水,Y的摩尔质量为1.96g/L×22.4L/mol=44g/mol,结合物质含有的元素,故Y为CO
2,固体X难溶于水,能溶于硫酸,形成蓝色溶液,为硫酸铜溶液,故X为CuO,即丙为碱式碳酸铜,生成的CO
2折合成标准状况下的体积为4.48L,物质的量为
=0.2mol,根据碳元素守恒可知CuCO
3为0.2mol,24gCuO的物质的量为
=0.3mol,根据铜元素守恒Cu(OH)
2为0.3mol-0.2mol=0.1mol,故碱式碳酸铜中n(CuCO
3):n[Cu(OH)
2]=0.2mol:0.1mol=2:1,故该碱式碳酸铜化学式为2CuCO
3?Cu(OH)
2,
(1)由上述分析可知,Y为CO
2,分子中碳原子与氧原子之间形成2对共用电子对,结构式为O=C=O,化合物丙为2CuCO
3?Cu(OH)
2;
故答案为:O=C=O,2CuCO
3?Cu(OH)
2;
(2)甲为Al
2O
3,Al
2O
3与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为:Al
2O
3+2OH
-=2AlO
2-+H
2O;
工业上常用Al
2O
3与焦炭、氯气共热生成化合物丁和CO,而丁仅由两种元素组成,由元素守恒可知丁为AlCl
3,反应方程式为Al
2O
3+3C+3Cl
23CO+2AlCl
3,C元素化合价由0价升高为+2,失去电子数为6,氯元素化合价由0价降低为-1价,获得电子数目为6,标出电子转移的方向和数目为:
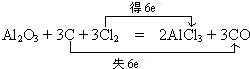
;
故答案为:Al
2O
3+2OH
-=2AlO
2-+H
2O;

;
(3)SiO
2溶于氢氟酸后生成一种极强的二元酸和水,该酸由3种元素组成,其中氟元素的质量分数为79.17%,分子中H原子数目为2,令该酸的化学式为:H
2Si
xF
y,根据化合价代数和为0可知2+4x-y=0,由氟元素质量分数有
=79.17%,联立解得x=1,y=6,故该酸为H
2SiF
6,故SiO
2溶于氢氟酸的离子反应方程式为:SiO
2+6HF=2H
++SiF
62-+2H
2O;
故答案为:SiO
2+6HF=2H
++SiF
62-+2H
2O;
(4)将固体CuO溶于适量的硫酸,往所得溶液中滴加NaOH浓溶液时,先出现蓝色絮状沉淀,为Cu(OH)
2,继续滴加NaOH浓溶液并不断振荡,则沉淀消失形成蓝色溶液,说明Cu(OH)
2具有两性,再滴加数滴乙二醇,可观察到溶液呈绛蓝色,羟基处于邻位的多元醇或多羟基化合物,能与氢氧化铜发生络合反应变成绛蓝色溶液,反应方程式为:
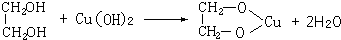
;
故答案为:C,

.





 ;
; ;
; ;
; .
.
