
 NaCl+NaClO+H2O ② 2Na + Cl2
NaCl+NaClO+H2O ② 2Na + Cl2 2NaCl
2NaCl  2Fe2+ + I2 ④ 2Fe2+ + Br2
2Fe2+ + I2 ④ 2Fe2+ + Br2 2Fe3+ + 2Br–
2Fe3+ + 2Br–科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2Al+Fe2O3 2Fe+Al2O3 2Fe+Al2O3 |
B.2Mg+CO2 2MgO+C 2MgO+C |
C.N2+3H2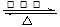 2NH3 2NH3 |
D.SiO2+CaO CaSiO3 CaSiO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
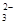 +O2+4OH-=Fe3O4+S4O
+O2+4OH-=Fe3O4+S4O +2H2O,下列说法正确的是( )
+2H2O,下列说法正确的是( )A.O2和S2O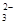 是氧化剂,Fe2+是还原剂 是氧化剂,Fe2+是还原剂 |
| B.每生成1mol Fe3O4,则转移电子数为2mol |
| C.参加反应的氧化剂与还原剂的物质的量之比为1:1 |
| D.若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KClO3在反应中得到电子 | B.1mol KClO3参加反应有2mol电子转移 |
| C.ClO2是氧化产物 | D.H2C2O4在反应中被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Se+I2+KNO3+H2O
Se+I2+KNO3+H2O Na2S4O6+2NaI
Na2S4O6+2NaI查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com