
| A. | ③⑤ | B. | ②④ | C. | ①③⑤ | D. | ①③ |
分析 含碳碳三键、双键、-CHO等可发生加成反应,含-OH、-COOH可发生酯化反应,碳碳三键、双键、-CHO、-OH均可发生氧化反应,以此来解答.
解答 解:①CH2OH(CHOH)4CHO中含-CHO可发生加成、氧化反应,含-OH可发生酯化、氧化反应,故选;
②CH3CH2CH2OH含-OH可发生酯化、氧化反应,不能发生加成反应,故不选;
③CH2═CH-CH2OH中-OH可发生酯化、氧化反应,含碳碳双键可发生加成、氧化反应,故选;
④CH2═CH-COOCH3中含碳碳双键可发生加成、氧化反应,不能发生酯化反应,故不选;
⑤CH2═CH-COOH中含碳碳双键可发生加成、氧化反应,含-COOH可发生酯化反应,故选;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应等为解答的关键,侧重分析与应用能力的考查,注意判断有机物中的官能团,题目难度不大.


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 18g D216O中含有的中子数为9NA | |
| B. | 1molCH3COONa和少量CH3COOH溶于水形成的中性溶液中,CH3COO-数目小于NA | |
| C. | 常温常压下,甲醛和冰醋酸的混合物共6.0g,其中含有的原子总数为0.8NA | |
| D. | 将1molCH3CH2OH催化氧化为CH3COOH,消耗的O2分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
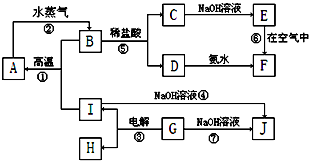
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
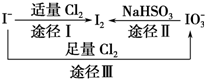 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系,根据图示转化关系推测下列说法不正确的是( )
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系,根据图示转化关系推测下列说法不正确的是( )| A. | 可用KI-淀粉试纸和食醋检验加碘盐中是否含有碘 | |
| B. | 足量Cl2能使湿润的KI-淀粉试纸变白的原因可能是:5Cl2+I2+6H2O═2HIO3+10HCl | |
| C. | 由图可知氧化性的强弱顺序为Cl2>I2>IO${\;}_{3}^{-}$ | |
| D. | 途径Ⅱ中若生成1 mol I2,反应中转移的电子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 碳酸钡溶于醋酸:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| C. | 金属钠跟水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 澄清石灰中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

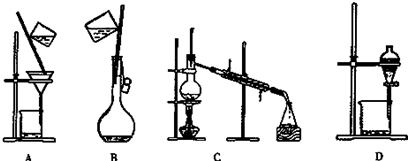
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<W<Z | |
| B. | 最高价氧化物对应水化物的酸性:W>R | |
| C. | 简单气态氢化物的热稳定性:Y>W | |
| D. | Y在周期表中的位置为第二周期ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ•mol-1氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H>0 则石墨比金刚石稳定 | |
| C. | 已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4 kJ•mol-1则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量 | |
| D. | 己知2C(s)+2O2(g)═2CO2(g);△H1 2C(s)+O2(g)═2CO(g);△H2,则△H1>△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com