
| A. | 农村用酸汤点豆腐 | B. | 有雾的清晨树林里的阳光 | ||
| C. | 澄清石灰水在空气中放置后变浑浊 | D. | 铁盐用于净水 |
分析 A.豆浆属于胶体分散系;
B.有雾的清晨树林里形成的是胶体,胶体能产生丁达尔效应;
C.氢氧化钙与二氧化碳反应生成碳酸钙沉淀;
D.铁盐净水是利用水解生成的氢氧化铁胶体的吸附杂质的作用;
解答 解:A.豆浆属于胶体分散系,酸汤中含电解质,豆浆中加入酸汤做豆腐是利用胶体遇电解质发生聚沉的性质,与胶体有关,故A错误;
B.有雾的清晨树林里形成的是胶体,阳光照射会析出一条光亮的通路,发生丁达尔现象,和胶体有关,故B错误;
C.氢氧化钙与二氧化碳反应生成碳酸钙沉淀,与胶体无关,故C正确.
D.因铁盐水解生成氢氧化铁胶体,胶粒吸附带电,可以吸附水中带相反电荷的杂质,所以铁盐可净水与胶体有关,故D错误;
故选C.
点评 本题考查胶体的性质,明确胶体常见的性质有丁达尔现象、胶体的聚沉、电泳等,利用胶体性质对生产生活中实际问题进行解释,题目难度不大.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol/L | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/mol/L | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ax/100bmol/L | B. | ax/500bmol/L | C. | ax/2000bmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
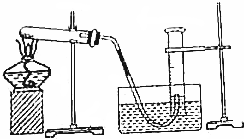
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
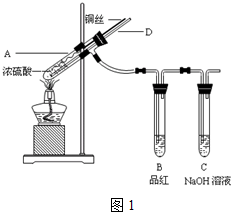

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
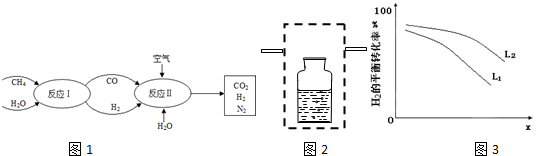
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com