
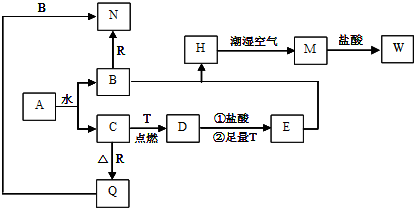


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| [OH-] |
| [NH3?H2O] |
查看答案和解析>>
科目:高中化学 来源: 题型:
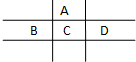 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同.
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油、煤、天然气、可燃冰、植物油都属于化石燃料 |
| B、对于一块高分子材料,n是一个整数值,因而它的相对分子质量是确定的 |
| C、在酯化反应中,羧酸脱去羧基中的羟基,醇脱去氢原子生成水和酯 |
| D、糖类物质又叫碳水化合物,其分子式都可以用Cn(H2O)m表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2、I2、HI的浓度相等 |
| B、1个I-I键断裂的同时,有2个H-I键断裂 |
| C、混合气体的质量不再改变 |
| D、混合气体密度恒定不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com