


科目:高中化学 来源: 题型:阅读理解
| 3 |
| 2 |
| 1 |
| 3 |
| 2 |
| 3 |
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | a2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | a3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省新余市高三上学期期末质量检测化学试卷(解析版) 题型:填空题
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应 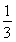 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g) 
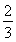 Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1. 0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率=____________
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
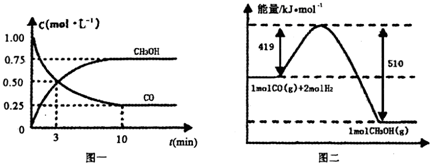
CO(g)+ 2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
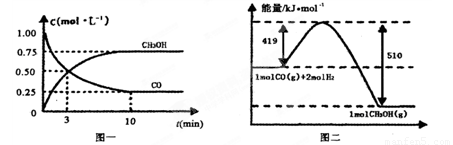
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是________
A.c1=c2????? B.2Q1=Q3??? C.2α1=α3?????? D.α1+α2 =1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
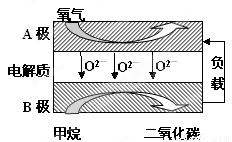
(1)B极上的电极反应式为????????????????????????????????????????????
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为???????????? (标况下)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北石家庄市高考猜题化学试卷(解析版) 题型:填空题
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I. 已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+ 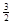 O2(g)=Fe2O3(s),ΔH=-825.5
kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5
kJ·mol-1
 反应:Fe2O3(s)+
3CO(g)
反应:Fe2O3(s)+
3CO(g)  2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
Ⅱ. 反应
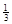 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
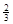 Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=____________.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________.
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+
2H2(g)  CH3OH(g).请根据图示回答下列问题:
CH3OH(g).请根据图示回答下列问题:
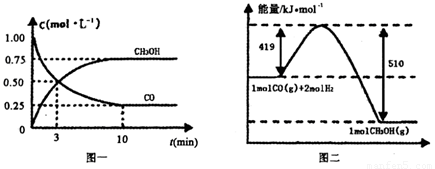
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________.
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
|
容器 |
反应物投入的量 |
反应物的 转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
|
甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1kJ热量 |
|
乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2kJ热量 |
|
丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是________.
A.c1=c2
B.2Q1=Q3
C.2a1=a3
D.a1 +a2 =1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式______________________.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省石家庄市高三补充题、压轴题化学试卷(解析版) 题型:填空题
.(13分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+
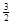 O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
反应:Fe2O3(s)+
3CO(g)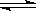 2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
Ⅱ.反应 1/3Fe2O3(s)+
CO(g)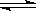 2/3Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
2/3Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=____________.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________.
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+
2H2(g)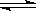 CH3OH(g).请根据图示回答下列问题:
CH3OH(g).请根据图示回答下列问题:
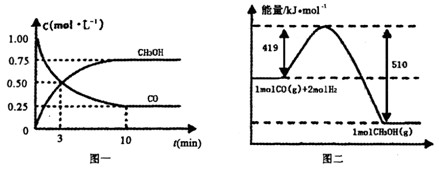
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________.
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
|
容器 |
反应物投入的量 |
反应物的 转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
|
甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1 kJ热量 |
|
乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2 kJ热量 |
|
丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3 kJ热量 |
则下列关系正确的是________.
A c1=c2 B.2Q1=Q3 C. 2α1=α2 D. α1+α2=1
E. 该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l mol CO、2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式___ ____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com