
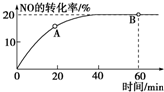
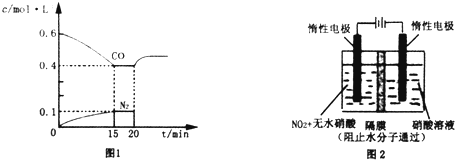
 (1)某温度下,向容积为1L的容器中充入3mol NO和1mol CO,发生2NO(g)+2CO(g)???N2(g)+2CO2(g)反应,NO的转化率随时间的变化如图所示.
(1)某温度下,向容积为1L的容器中充入3mol NO和1mol CO,发生2NO(g)+2CO(g)???N2(g)+2CO2(g)反应,NO的转化率随时间的变化如图所示.分析 (1))①该温度下,由图象可知达到平衡时NO转化率为20%,则NO转化的物质的量为:3mol×20%=0.6mol,根据反应2NO(g)+2CO(g)═N2(g)+2CO2(g)可知:CO转化了0.6mol,反应生成氮气、二氧化碳分别为0.3mol,0.6mol,则平衡时各物质浓度分别为:c(NO)=$\frac{3mol-0.6mol}{1L}$=2.4mol/L、c(CO)=$\frac{1mol-0.6mol}{1L}$=0.4mol/L、c(N2)=$\frac{0.3mol}{1L}$=0.3mol/L、c(CO2)=$\frac{0.6mol}{1L}$=0.6mol/L,然后根据化学平衡常数表达式计算即可;平衡时CO的转化率=$\frac{反应转化的物质的量}{反应前总物质的量}$×100%;
②根据随着反应时行反应物浓度减小,反应速率减小判断A点的逆反应速率逆V逆(CO)与B点的逆反应速率V逆(NO)大小;
(2)①1g液态肼完全反应生成气态水放出的热量为20kJ,据此书写热化学风程式;结合写出的热化学方程式和谁转化的热化学方程式,根据盖斯定律合并写出生成液态水时的热化学方程式进行计算;
②化学反应中,化学键断裂吸收能量,形成新化学键放出能量,化学反应的焓变=旧键断裂吸收的能量-新键生成释放的能量.
解答 解:(1)①该温度下,由图象可知达到平衡时NO转化率为20%,则NO转化的物质的量为:3mol×20%=0.6mol,根据反应2NO(g)+2CO(g)═N2(g)+2CO2(g)可知:CO转化了0.6mol,反应生成氮气、二氧化碳分别为0.3mol,0.6mol,则平衡时各物质浓度分别为:c(NO)=$\frac{3mol-0.6mol}{1L}$=2.4mol/L、c(CO)=$\frac{1mol-0.6mol}{1L}$=0.4mol/L、c(N2)=$\frac{0.3mol}{1L}$=0.3mol/L、c(CO2)=$\frac{0.6mol}{1L}$=0.6mol/L,
将数据代入化学平衡常数表达式可得:K=$\frac{0.3×0.{6}^{2}}{2.{4}^{2}×0.{4}^{2}}$=$\frac{15}{128}$;
平衡时CO的转化率为:$\frac{0.6mol}{1mol}$×100%=60%,
故答案为:$\frac{15}{128}$;60%;
②由于随着反应时行反应物浓度减小,速率减小,故A点的逆反应速率逆V逆(CO)小于B点的逆反应速率V逆(NO),
故答案为:<;
(2)①1g液态肼完全反应生成气态水放出的热量为20kJ,所以1mol即32g液态肼完全反应生成气态水放出的热量为640kJ,即①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63kJ/mol;②H2O(g)=H2O(l)△H=-44kJ/mol;
依据盖斯定律①+②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l);△H=-816kJ/mol,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l);△H=-816kJ/mol;
②由N2、H2合成气态肼(N2H4)的反应为:N2(g)+2H2(g)═N2H4(g)焓变=946kJ•mol-1+2(436kJ•mol-1)-[4(390.8kJ•mol-1)+193kJ•mol-1]=+61.8 kJ•mol-1,故答案为:N2(g)+2H2(g)═N2H4(g)△H=+61.8 kJ•mol-1.
点评 本题考查了化学平衡的计算、反应热计算,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握化学键断裂、形成中的能力变化与焓变之间的关系,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
下列说法正确的是
A.(CH3)3CCH2(CH3)C=CH2的名称为:2,2,4-三甲基-4-戊烯
B.碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种(不考虑顺反异构)
C.1mol有机物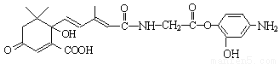 与NaOH溶液反应,最多消耗5molNaOH
与NaOH溶液反应,最多消耗5molNaOH
D.1molβ-紫罗兰酮(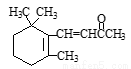 )与1molHBr发生加成反应可得到3种不同产物
)与1molHBr发生加成反应可得到3种不同产物
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
下列关于物质的用途正确的是( )
A.在医疗上碳酸钠、Al(OH)3均可用于治疗胃酸过多
B.人造刚玉的熔点很高,可用作高级耐火材料,其主要成分是SiO2
C.水玻璃可用于生产粘合剂和防火剂
D.自来水中加入少量明矾,水解生成Al(OH)3胶体可以起到杀菌消毒的作用
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$
(g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$ (g)+3H2(g).
(g)+3H2(g).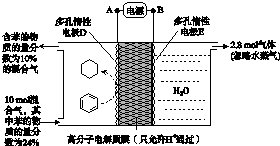
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
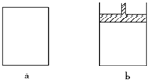 有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生反应:
有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com