
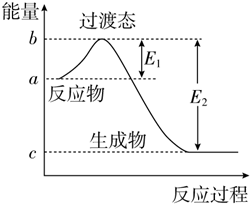
 如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )
如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )| A. | 若在反应体系中加入催化剂,E1不变 | |
| B. | 若在反应体系中加入催化剂,△H减小 | |
| C. | 反应的活化能等于y kJ•mol-1 | |
| D. | 1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的△H=(x-y) kJ•mol-1 |
分析 催化剂能降低反应的活化能,所以E1变小,但催化剂不会改变化学反应的反应热,所以△H不变,反应热等于反应物的键能总和与生成物的键能总和之差,即△H=E1-E2,据此解答.
解答 解:催化剂能降低反应的活化能,所以E1变小,但催化剂不会改变化学反应的反应热,所以△H不变,反应热等于反应物的键能总和与生成物的键能总和之差,即△H=E1-E2,
A.若在反应体系中加入催化剂,E1变小,故A错误;
B.催化剂不会改变化学反应的反应热,所以△H不变,故B错误;
C.由图可知,反应的活化能等于E1=x kJ•mol-1,故C错误;
D.1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的△H=E1-E2=(x-y) kJ•mol-1,故D正确;
故选D.
点评 本题结合能量变化示意图,考查反应热的计算,注意催化剂是降低活化能,但不改变反应热,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA | |
| B. | 0.5mol/L MgCl2溶液中,含有Cl-离子数为NA | |
| C. | 2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 1mol碳正离子(CH 3+)所含的电子总数为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是个放热反应 | |
| B. | 反应物的总能量高于生成物的总能量 | |
| C. | H2O2仅为氧化剂 | |
| D. | H2O2既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
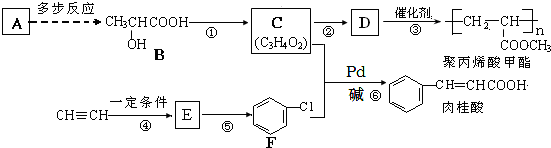
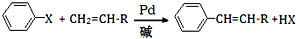 (X为卤原子,R为取代基)
(X为卤原子,R为取代基) ;反式肉桂酸的结构简式为
;反式肉桂酸的结构简式为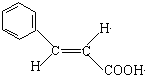 .
.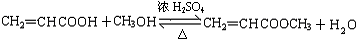 ;
;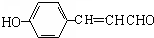 (写结构简式).
(写结构简式).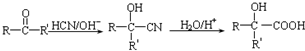 ,设设计由A(C2H4)制备B的合成路线(无机试剂任选):
,设设计由A(C2H4)制备B的合成路线(无机试剂任选):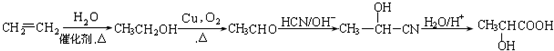 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 3 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
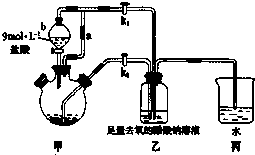 醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种为红棕色晶体,极易被氧气氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂).
醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种为红棕色晶体,极易被氧气氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com