
| A. | 钠具有良好的导电性,密度比水的小 | |
| B. | 钠在空气中最后变为白色的碳酸钠 | |
| C. | Ca(OH)2饱和溶液中加入Na的小颗粒,会析出固体 | |
| D. | 钠在工业上用于制造氯化钠、氢氧化钠、碳酸钠等化合物 |
分析 A、钠具有良好的导电性,钠密度比水的小;
B、根据钠长期暴露在空气中,发生的一系列变化:切开金属钠置于空气中,切口开始呈银白色→变暗→变白色固体→成液→结块→最后变成Na2CO3粉末;
C、溶剂的质量减少,导致溶液成为过饱和溶液;
D、把化合态的钠提纯成单质钠再去制化合态的钠,成本太高.
解答 解:A.钠具有良好的导电性,钠与水反应浮在水面上,则密度比水的小,故A正确;
B.切开金属钠置于空气中,切口开始呈银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO3•10H2O)→最后变成Na2CO3粉(风化),有关反应如下:4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO3•10H2O、Na2CO3•10H2O=Na2CO3+10H2O,故B正确;
C.Ca(OH)2饱和溶液中加入Na的小颗粒,钠与水反应消耗溶剂,溶剂的质量减少,导致溶液成为过饱和溶液,会析出部分氢氧化钙固体,故C正确;
D.Na的性质活泼,一般在自然界不存在单质钠,把化合态的钠提纯成单质钠再去制化合态的钠,成本太高,故D错误.
故选D.
点评 本题考查学生金属钠的化学性质知识,明确物质的性质是解本题关键,难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:推断题

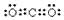
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2molH2O和D2O形成的混合物中,含有中子的数目为2NA | |
| B. | 含有0.1molNH4+的氨水中,含有OH-的数目为0.1NA | |
| C. | 400mL1mol•L-1稀硝酸与Fe完全反应(还原产物只有NO),转移电子的数目为0.3NA | |
| D. | 30g乙酸和乙酸乙酯的混合物完全燃烧,消耗O2的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ | |
| B. | 为检验红砖中铁的价态,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴,溶液变为红色,说明红砖中只有三氧化二铁 | |
| C. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| D. | 将(NH4)2Fe(SO4)2•6H2O试样溶于稀硝酸中,滴加KSCN溶液,出现血红色,说明检验前该试样已变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第IIA族元素的金属性比第IIIA族元素的强 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | O2-、F-、Na+、Mg2+半径逐渐减小 | |
| D. | 16O与18O得电子能力前者强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴阳离子间通过静电吸引形成的化学键叫做离子键 | |
| B. | HF,HCl,HBr,HI的热稳定性依次增强 | |
| C. | 元素非金属越强,其对应含氧酸的酸性就越强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com