
在水溶液中能大量共存的离子组是 ( )
A.K+ 、Al3+ 、SO42-、OH- B.Ca2+ 、Na+、Cl-、NO3-
C.Na+ 、NH4+ 、NO3-、OH- D.Na+ 、H+ 、CO32-、Cl-
科目:高中化学 来源: 题型:
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2 (s)+Mn2O3(s),下列说法错误的是( )
(s)+Mn2O3(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极反应为2MnO2(s)+H2O(l)+2e-―→Mn2O3(s)+2OH-(aq)
C.电池工作时,负极附近溶液碱性增强
D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是
A.漂白粉长时间露置空气中会结块变质
B.金属钠在空气中燃烧产生黄色火焰,生成淡黄色固体
C.为防船体被腐蚀,远洋货轮船底外壳镶嵌锌块,其中锌发生还原反应
D.两根分别蘸有浓盐酸、浓氨水的玻璃棒靠近有白烟产生
查看答案和解析>>
科目:高中化学 来源: 题型:
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组用模拟制备氨基甲酸铵,反应的化学方程式如下:
 2 NH3(g)+CO2(g)
2 NH3(g)+CO2(g)  NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
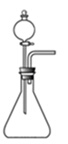
(1)如用右图装置制取氨气,你所选择的试剂是 。
(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。 当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是___________ __ _____________。液体石蜡鼓泡瓶的作用是______________________________ __。
②从反应后的混合物中分离出产品的实验方法是_______(填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a. 常压加热烘干 b. 高压加热烘干 c. 真空40 ℃以下烘干
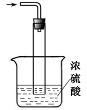 ③尾气处理装置如右图所示。双通玻璃管的作用:_______ ;浓硫酸的作用: 、_______________________ _。
③尾气处理装置如右图所示。双通玻璃管的作用:_______ ;浓硫酸的作用: 、_______________________ _。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.782 0 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为___________。
[Mr(NH2COONH4)=78、Mr(NH4HCO3) =79、Mr(CaCO3)=100]
查看答案和解析>>
科目:高中化学 来源: 题型:
在100mL0.1mol/L醋酸溶液中加入以下物质中的一种,醋酸溶液pH变小。所加入的这种物质是 ( )
A.水 B. 0.1mol/L盐酸 C. 醋酸钠晶体 D. 0.1mol/L氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关铝及其化合物的叙述正确的是
A.铝粉与氧 化镁共热可制取金属镁
化镁共热可制取金属镁
B.足量铝分别与含1 mol HCl、1 mol  NaOH的溶液反应,产生相同量的氢气
NaOH的溶液反应,产生相同量的氢气
C.工业上用电解熔融Al2O3的方法冶炼铝
D.在浓硝酸中加入等体积的浓硫酸后,立即加入铝片,铝片表面发生钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
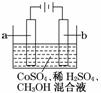 电化学原理广泛用于工业生产中,如有一种电化学净水法的原理是:在电解过程中将低价金属离子(如Co2+)氧化成高价态的离子(Co3+),然后以此高价态的金属离子作氧化剂把废水中的有机物氧化成CO2而净化。实验室用如图装置模拟上述过程,下列说法正确的是
电化学原理广泛用于工业生产中,如有一种电化学净水法的原理是:在电解过程中将低价金属离子(如Co2+)氧化成高价态的离子(Co3+),然后以此高价态的金属离子作氧化剂把废水中的有机物氧化成CO2而净化。实验室用如图装置模拟上述过程,下列说法正确的是
( )
A.电极a可以是石 墨,电极b可以是铜
墨,电极b可以是铜
B.电解后阴极附近H+浓度不变
C.Co3+氧化甲醇的离子方程式为:6Co3++CH3OH+H2O===CO2↑+6Co2++6H+
D.当1 mol 甲醇被完全氧化时,阳极应该失去4 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com