
实验室用铅蓄电池进行电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极为Pb+ ====PbSO4+2e-,正极为PbO2+4H++
====PbSO4+2e-,正极为PbO2+4H++ +2e-====PbSO4+2H2O,今若制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
+2e-====PbSO4+2H2O,今若制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
A.0.025 mol B.0.050 mol C.0.10 mol D.0.20 mol
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
我省盛产矿盐(主要成分是NaCl,还好有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
A. 有矿盐生成食盐,除去SO42- 最合适的实际是Ba( NO3)2
NO3)2
B. 工业上通过电解氯化钠溶液制备金属钠和氯气
C. 室温下,AgCl在水中的溶解度小于在食盐中的溶解度zxxk
D. 用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某物质E可做香料,其结构简式为 ,工业合成路线如下:
,工业合成路线如下:


回答下列问题:
(1)A为芳香烃,相对分子质量为78。下列关于A的说法中,正确的是____________(填序号);
A. 密度比水大 B. 所有原子均在同一平面上 C. 一氯代物只有一种
(2)B的结构简式可能是____________、____________;
(3)步骤④的化学方程式是________________________;
(4)E有多种同分异构体,写出符合以下条件的结构简式____________(只写反式结构)。
①具有顺反结构 ②能与NaOH溶液反应 ③分子中苯环上的一溴代物有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ. 实验室制得气体中常含有杂质,影响其性质检验。
下图A为除杂装置,B为性质检验装置,完成下列表格:

| 序号 | 气体 | 反应原理 | A中试剂 |
| ① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | ______________ |
| ② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是________________________ | NaOH溶液 |
| ③ | 乙炔 | 电石与饱和食盐水反应 | _______________ |
Ⅱ. 为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
| 试管编号 | ① | ② | ③ |
| 实验操作 |
|
|
|
| 实验现象 | 酯层变薄 | 酯层消失 | 酯层基本不变 |
(1)试管①中反应的化学方程式是________________________;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是________________________;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能用电化学理论解释的是( )
A.轮船水线以下的船壳上装一定数量的锌块
B.铝片不用特殊方法保存
C.纯锌与稀硫酸反应时,滴入少量浓H2SO4溶液后速率加快
D.镀锌铁不如镀锡铁耐用
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA
B.常温常压下,7.0 g乙烯与丙烯的混合物中含有碳氢键的数目为NA
C.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数
目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成氨与制备硝酸一般可连续生产,流程如图所示:
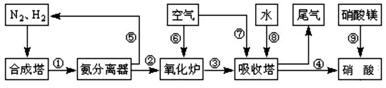
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____573K(填“>”、“<”或“=”)。
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____573K(填“>”、“<”或“=”)。
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图所示。温度高于900℃时,NH3产率下降的原因是

(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2=(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(5)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.除稀有气体外的非金属元素都能生成不同价态的含氧酸
B.若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数一定为m+11
C.在BrCH=CHBr分子中,C—Br键采用的成键轨道是sp—p
D.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,可能是含有共价键的离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com