
����Ŀ����֪25 ��ʱ������ʵĵ���ƽ�ⳣ���� Ka(CH3COOH)��1.8��10��5��Ka(HSCN)��0.13����20 mL 0.10 mol��L��1CH3COOH��Һ��20 mL 0.10 mol��L��1��HSCN��Һ�ֱ���0.10 mol��L��1��NaHCO3��Һ��Ӧ��ʵ���ò���CO2�������(V)��ʱ��t�Ĺ�ϵ��ͼ��ʾ����Ӧ��ʼʱ��������Һ����CO2���������Բ�ͬ��ԭ����___________
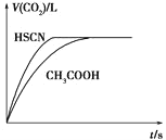
���𰸡���ΪHSCN�ĵ���ƽ�ⳣ������CH3COOH����ƽ�ⳣ����������ͬŨ�ȵ�������Һ��H+Ũ��ΪHSCN > CH3COOH��c��H+��Խ����NaHCO3��Ӧ����CO2������Խ�졣
��������
��������������Һ����CO2���������Բ�ͬ��֪�����⿼�鷴Ӧ���ʣ�������ĵ���ƽ�ⳣ��������
������֪Ka(CH3COOH)��1.8��10��5��Ka(HSCN)��0.13��HSCN�ĵ���ƽ�ⳣ������CH3COOH����ƽ�ⳣ�������20 mL 0.10 mol��L��1��CH3COOH��Һ��HSCN��Һ��H+Ũ��ΪHSCN > CH3COOH��c��H+��Խ����NaHCO3��Ӧ����CO2������Խ�졣
�ʴ�Ϊ����ΪHSCN�ĵ���ƽ�ⳣ������CH3COOH����ƽ�ⳣ����������ͬŨ�ȵ�������Һ��H+Ũ��ΪHSCN > CH3COOH��c��H+��Խ����NaHCO3��Ӧ����CO2������Խ�졣


 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������淶���ܴﵽĿ�ĵ���
Ŀ�� | ���� | |
A�� | ȡ20.00 mL���� | ��50 mL��ʽ�ζ�����װ�����ᣬ������ʼ����Ϊ30.00 mL��ʣ�����������ƿ |
B�� | �ⶨ��������ҺpH | �ò�����պȡ��Һ������ʪ���pH��ֽ�� |
C�� | ��ϴ������ʵ�������Թ� | ���þƾ���ϴ������ˮ��ϴ |
D�� | ����Ũ��Ϊ0.010 | ��ȡKMnO4����0.158 g������100 mL����ƿ�У���ˮ�ܽⲢϡ�����̶� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����ͼ��ʾ��װ�ý���ʵ�顣 A��BΪ���ֳ������������ǵ������ο�����ˮ���� K �պ�ʱ���ڽ���Ĥ�� SO42-���������ƶ������з�����ȷ����
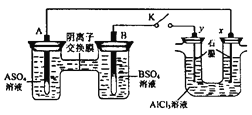
A.��Һ��A2+Ũ�ȼ�С
B.B �ĵ缫��Ӧ�� B��2e��=B2+
C.y �缫���� H2������������ԭ��Ӧ
D.��Ӧ���ڣ�x�缫��Χ���ְ�ɫ��״���������ó����ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����84����Һ���������г��õ����������������ᷴӦ��ȡ��������Ӧԭ��ΪNaClO��NaCl��H2SO4![]() Na2SO4��Cl2����H2O��Ϊ̽�����������ʣ�ijͬѧ���ô�ԭ�����������������ͼ��ʾ��ʵ��װ�á�
Na2SO4��Cl2����H2O��Ϊ̽�����������ʣ�ijͬѧ���ô�ԭ�����������������ͼ��ʾ��ʵ��װ�á�

(1)�����Ʊ������ķ�Ӧ�У�ÿ����1molCl2��ת�Ƶĵ��ӵ����ʵ�����________mol��
(2)����������Ӧԭ����������װ����ѡ����ʵ�������װ��(A��)________(�����)��

(3)װ��B��C������ʢ�ŵ��Ǹ���ĺ�ɫ������ʪ��ĺ�ɫ��������Ŀ����________��ʵ������и�ͬѧ����װ��B�еIJ���Ҳ��ɫ��˵����װ�ô������Ե�ȱ�ݣ��Ľ��ķ�����________��
(4)E��NaOH��Һ��������ʱ������Ӧ�Ļ�ѧ����ʽ��________��
(5)D�������ɽ�![]() ��������ͨ��ʵ����֤�÷�Ӧ��������������ԭ��Ӧ���ɲ�ȡ�ķ�����________(д���������Լ�������)��
��������ͨ��ʵ����֤�÷�Ӧ��������������ԭ��Ӧ���ɲ�ȡ�ķ�����________(д���������Լ�������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�в��������ʱ仯���Ұ����������仯��
(1)����ʵ�����������ȷ�Ӧ����________(�����)��
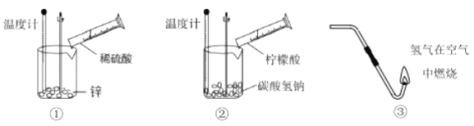
(2)��ͼ�У���ʾ���ȷ�Ӧ�����仯����_______(����ĸ)��
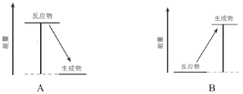
(3)���۽Ƕȷ�����ѧ��Ӧ�������仯��ԭ��

ͼ�Тٺ͢ڷֱ�Ϊ_______��_______(���������������ͷ���)��������������Ӧ����1molˮ����ʱ���ͷ�________kJ������
(4)��ǰ���ܶ������������Ȼ�����ú��Ϊ����ȼ�ϣ������±��Ӿ����ܶ�ĽǶȷ�����ԭ����__��
ȼ�� | ȼ���ͷŵ�����(ÿ1ǧ��) |
��Ȼ�� | 55812kJ |
ú | 20908kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��101kPa��25�������£�2 mol������ȫȼ������ˮ�����ų�484kJ�������������Ȼ�ѧ����ʽ��ȷ���ǣ� ��
A.H2O(g)��H2(g)+![]() O2(l) ��H��+242kJ/mol
O2(l) ��H��+242kJ/mol
B.2H2 (g)+O2(g)��2H2O(l) ��H��-484kJ/mol
C.H2(g)+![]() O2(g)��H2O(g) ��H��-242kJ/mol
O2(g)��H2O(g) ��H��-242kJ/mol
D.2H2(g)+O2(g)��2H2O(g) ��H��+484kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g����H2��g��![]() CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��___��
��2���÷�ӦΪ___��Ӧ��ѡ�����ȡ����ȣ���
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������___����ѡ�۷֣���
a��������H2����������H2O�� b����Ӧֹͣ�������淴Ӧ���ʶ�������
c��������ѹǿ���ٷ����仯 d�����������c��CO2������
��4��ij�¶��£���2L���ܱ������У�����1 molCO2��1molH2��ַ�Ӧ��ƽ��ʱ��COƽ��Ũ��Ϊ0.25mol/L�����жϴ�ʱ���¶�Ϊ__�档
��5�����ڣ�4���������¶��£���1L���ܱ������У�����2molCO2��3molH2��ַ�Ӧ��ƽ��ʱ��CO2��ƽ��ת����Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��Ǹ������������������Ϊ�����һ����¯��������Ϊ�ձ������������
������֪��2CO(g) + O2(g)��2CO2(g) ��H����566 kJ/mol
2Fe(s) + 3/2O2(g)��Fe2O3(s) ��H����825.5 kJ/mol
��Ӧ��Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ��H��________ kJ/mol��
2Fe(s)+3CO2(g) ��H��________ kJ/mol��
������Ӧ1/3Fe2O3(s)+CO(g)![]() 2/3 Fe(s)+CO2(g)��1000����ƽ�ⳣ������4.0����һ�ݻ�Ϊ10 L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0 mol����Ӧ����10min��ﵽƽ�⡣
2/3 Fe(s)+CO2(g)��1000����ƽ�ⳣ������4.0����һ�ݻ�Ϊ10 L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0 mol����Ӧ����10min��ﵽƽ�⡣
��1��CO��ƽ��ת����Ϊ __________��
��2�������CO��ƽ��ת���ʣ��ٽ�Fe2O3��ת�����ɲ�ȡ�Ĵ�ʩ�� _________��
a����߷�Ӧ�¶�
b������Ӧ��ϵ��ѹǿ
c��ѡȡ���ʵĴ���
d����ʱ���ջ��Ƴ�����CO2
e�������ʯ��ʹ����ƽ���������ֽӴ�
������¯���������ķ����е�CO�ɽ��л��գ�ʹ����һ����������H2��Ӧ�Ʊ��״��� CO(g)+2H2(g)![]() CH3OH(g)�������ͼʾ�ش��������⣺
CH3OH(g)�������ͼʾ�ش��������⣺
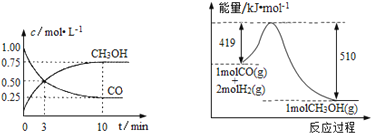
��1���ӷ�Ӧ��ʼ��ƽ�⣬��H2Ũ�ȱ仯��ʾƽ����Ӧ������(H2)��_____________��
��2�������¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ��ʱ���й��������±���
���� | ��Ӧ��Ͷ����� | ��Ӧ�� ת���� | CH3OH��Ũ�� | �����仯 ��Q1��Q2��Q3������0�� |
�� | 1 molCO��2 molH2 | ��1 | c1 | �ų�Q1 kJ���� |
�� | 1 molCH3OH | ��2 | c2 | ����Q2 kJ���� |
�� | 2 molCO��4 molH2 | ��3 | c3 | �ų�Q3 kJ���� |
�����й�ϵ��ȷ���� _________������ţ���
A��c1��c2��B��2Q1��Q3��C��2��1����3��D����1+��2=1��E���÷�Ӧ������1 molCH3OH����ų���Q1+Q2��kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����( )
A.��ʯī��������ͭ��������ⱥ��ʳ��ˮ��2Cl����2H2O![]() Cl2����H2����2OH��
Cl2����H2����2OH��
B.0.01 mol��L��1NH4Al(SO4)2��Һ��0.02 mol��L��1Ba(OH)2��Һ�������ϣ�
NH4����Al3����2SO42����2Ba2����4OH����2BaSO4����Al(OH)3 ����NH3��H2O
C.��0.1 mol FeI2����Һ�еμӺ�0.1 mol Cl2����ˮ��2Fe2����2I����2Cl2��2Fe3����I2��4Cl��
D.����KMnO4��Һ��˫��ˮ��Ӧ��2MnO4����10H����3H2O2��2Mn2����3O2����8H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com