
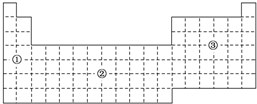
 如果把元素周期表分为下面3个区域,则最活泼的金属、最活泼的非金属、最不活泼的非金属元素分别位于( )
如果把元素周期表分为下面3个区域,则最活泼的金属、最活泼的非金属、最不活泼的非金属元素分别位于( )| A. | ①区、③区、③区 | B. | ①区、③区、②区 | C. | ①区、②区、②区 | D. | ②区、③区、③区 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏,石油的裂化和裂解均属于化学变化 | |
| B. | 利用铝热反应可以冶炼Fe、Cr、Mn、W、Na等金属 | |
| C. | 甲烷和氯气制备一氯甲烷的原子利用率可达100% | |
| D. | SO2、NO2、CO2均是导致酸雨的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Al<Mg<F | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有性脱水性 | |
| B. | 硫粉在过量的氧气中燃烧可以生成SO3 | |
| C. | 将SO2通入BaCl2溶液能生成白色沉淀 | |
| D. | 可用澄清石灰水溶液鉴别 CO2和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 2:7 | C. | 1:2 | D. | 8:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com