
【题目】硝酸与金属反应时,浓度越稀还原产物价态越低。现用一定量的铝粉与镁粉组成的混合物与100mL硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,向反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与产生的沉淀质量的关系如图所示。
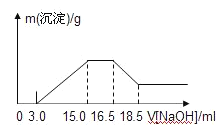
下列结论正确的是
A.铝与混合溶液反应的离子方程式为8Al+3OH-+3NO3-→8Al3++3NH4++9H2O
B.参加反应硝酸根离子物质的量为0.06 mol
C.参加反应的铝与镁的质量之比为4︰3
D.混合液中硫酸的物质的量的浓度为0.36 mol/L
【答案】AD
【解析】
A. 硝酸根浓度很低时被氧化生成的产物是铵根离子,因此无气体放出,镁、铝反应生成金属阳离子,则离子反应分别为4Mg+10H++NO3-═4Mg2++NH4++3H2O、8Al+3OH-+3NO3-=8Al3++3NH4++9H2O,A项正确;
B. 由图示可以看出加入氢氧化钠溶液从15.0mL到16.5mL区间内发生的反应是氢氧根离子与铵根离子的反应,由氮原子守恒可知,铵根离子的物质的量即为原溶液中反应的硝酸根离子的物质的量,则原溶液中NO3-物质的量是(16.5-15)×10-3L×4mol/L=0.006mol,B项错误;
C. 从图示提示中看出从氢氧化溶液体积16.5mL到18.5mL区间内发生的反应是氢氧化铝与氢氧化钠的反应,氢氧化铝与氢氧化钠等物质的量反应,由Al~Al3+~Al(OH)3~NaOH,则Al的物质的量为0.008mol,再由Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,沉淀镁离子和铝离子共消耗氢氧化钠溶液体积(15.0-3.0)mL,由此可知:沉淀镁离子时消耗的氢氧根离子物质的量为(15.0-3.0)×10-3L×4.00mol/L-8×10-3mol×3=24×10-3mol,镁离子物质的量为1.2×10-2mol,参加反应的镁与铝的质量之比:8×10-3mol×27g/mol:1.2×10-2mol×24g/mol=3:4,C项错误;
D. 由4Mg+10H++NO3-═4Mg2++NH4++3H2O、8Al+30H++3NO3-=8Al3++3NH4++9H2O可知,消耗氢离子为0.008mol×![]() +1.2×10-2mol×
+1.2×10-2mol×![]() =0.06mol,图中开始3.0mLNaOH溶液消耗氢离子的物质的量为3×10-3L×4mol/L=0.012mol,原溶液中硫酸的物质的量为
=0.06mol,图中开始3.0mLNaOH溶液消耗氢离子的物质的量为3×10-3L×4mol/L=0.012mol,原溶液中硫酸的物质的量为![]() =0.036mol,混合液中硫酸的物质的量的浓度为
=0.036mol,混合液中硫酸的物质的量的浓度为![]() =0.36mol/L,D项正确;
=0.36mol/L,D项正确;
答案选AD。


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】聚合物F筒称PETA,可利用于新型的普适无卤阻燃体系。图是以A为原料合成聚合物F的路线:
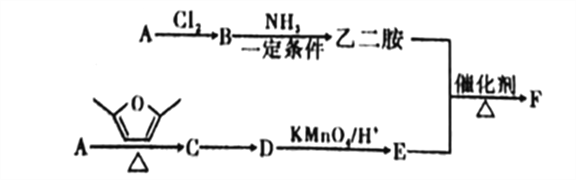
已知: ①A为与氢气的相对密度是14的烃;
②![]() ;
;
③D、E均为芳香化合物,它们的核磁共振氢谱显示均为2组峰。
回答下列问题:
(1)A中的官能团名称为_______,B的名称是______。
(2)B与NH3在一定条件的反应类型为___________。
(3)C的结构简式为___________。
(4)由C转化为D的反应中,除D外,另外一种生成物是___________。
(5)乙二胺和E反应生成聚合物F的化学方程式为___________,反应类型为___________。
(6)E的同分异构体中,满足以下条件的共有_____种(不含立体异构)。
①遇到FeCl3溶液会显色;②能发生银镜反应;③能与NaHCO3溶液反应。
(7)参照上述合成路线,以1,3-丁二烯为原料(无机试剂任选),设计制备![]() 的合成路线:_____________________________。
的合成路线:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明SO2具有漂白性的是( )
A.酸性![]() 溶液中通入
溶液中通入![]() 气体后紫红色消失
气体后紫红色消失
B.滴有酚酞的NaOH溶液中通入![]() 气体后红色消失
气体后红色消失
C.品红溶液中通入![]() 气体后红色消失
气体后红色消失
D.溴水中通入![]() 气体后橙色消失
气体后橙色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH(aq),生成沉淀的质量与滴入NaOH(aq)的体积关系如图。原混合溶液中MgCl2与FeCl3的物质的量之比为
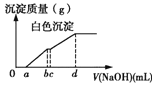
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 常温常压下,48g O3含有的氧原子数为3NA
B. 标准状况下,22.4L Cl2与足量的Fe反应转移的电子数为3NA
C. 已知可逆反应:2NO2![]() N2O4,将2molNO2放入反应容器中,生成的N2O4的物质的量一定是1mol
N2O4,将2molNO2放入反应容器中,生成的N2O4的物质的量一定是1mol
D. 58.5gNaCl固体溶于1L的水中,所得溶液的物质的量浓度为1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛性能优越,被誉为继 Fe、Al 后应用广泛的“第三金属”。
(1)Ti 基态原子的价层电子排布图为_____。
(2)钛能与 B、C、N、O 等非金属元素形成稳定的化合物。电负性C_____(填“>”或“<”,下同) B;第一电离能:N_O,原因是_________。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3 与 80%的硫酸反应可生成TiOSO4。SO42-的空间构型为_____形,其中硫原子采用______杂化,写出 SO42- 的一种等电子体的化学式________。
(4)Ti 的氧化物和 CaO 相互作用能形成钛酸盐 CaTiO3,CaTiO3 的晶体结构如图 1 所示,(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围 _______个 O2-相紧邻。
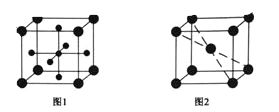
(5)铁晶胞的结构如图 2 所示,如果晶胞边长为 a,铁原子半径为 r,则该晶体中铁原子的空间利用率为______。(只含Π的代数式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的恒温、恒压密闭容器中加入2mol X和2mol Y,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?) ![]() a Z(g)。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:
a Z(g)。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:

(1)a = _________________;
(2)平衡时Y的转化率=________________
(3)X的状态为______________,Y的状态为______________(填“气态”或“非气态”)
(4)下列叙述中,能说明上述反应达到平衡状态的是____________(填编号)
a.气体密度不变 b.单位时间内消耗2mol X,同时生成amol Z
c.Y的转化率不再变化 d.Z的浓度不再变化
e.气体的质量不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-十Li+=LiM1-x FexPO4,其原理如图所示,下列说法正确的是
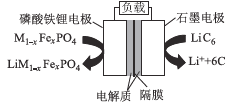
A.放电时,电流由石墨电极流向磷酸铁锂电极
B.放电时,负极反应式为LiC6-e-=Li++6C
C.电池总反应为M1-xFexPO4+LiC6![]() Li M1-xFexPO4+6C
Li M1-xFexPO4+6C
D.充电时,Li+移向磷酸铁锂电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示仪器,设计一个实验装置,用此装置电解饱和食盐水,并测定阴极气体的体积(约6mL)和检验阳极气体的氧化性。
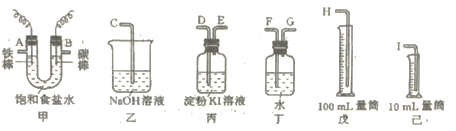
(1)必要仪器装置的接口字母顺序是:A接_____、____接____;B接___、____接____。
(2)电路的连接是:碳棒接电源的____极,电极反应方程式为_____。
(3)能说明阳极气体具有氧化性的实验现象是____,有关离子方程式是_____;最后尾气被吸收的离子方程式是______。
(4)如果装入的饱和食盐水体积为50mL(假定电解前后溶液体积不变),当测得的阴极气体为5.6mL(标准状况)时停止通电,则另一极实际上可收集到气体____(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)5.6mL,理由是______。
”)5.6mL,理由是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com