
| A. | 加入铝粉有大量氢气产生的溶液中:Ca2+、K+、NO3-、Cl- | |
| B. | PH=0的无色溶液中:Na+、K+、MnO4-、NO3- | |
| C. | 在0.1mol/L的盐酸中:Fe2+、Na+、ClO-、Ca2+ | |
| D. | 在含有大量Fe3+的溶液中:NH4+、Ca2+、Cl-、K+ |
分析 A.该溶液中存在大量氢离子或氢氧根离子,碱性条件下钙离子与氢氧根离子反应生成微溶物氢氧化钙,酸性条件下硝酸根离子与铝反应不会生成氢气;
B.高锰酸根离子为有色离子;
C.次氯酸根离子与亚铁离子、氢离子反应;
D.四种离子之间不反应,都不与铁离子反应.
解答 解:A.加入铝粉有大量氢气产生的溶液呈酸性或强碱性,Ca2+与氢氧根离子反应,酸性条件下NO3-具有强氧化性,与铝反应不会生成氢气,在溶液中一定不能大量共存,故A错误;
B.MnO4-为有色离子,不满足溶液无色的条件,故B错误;
C.Fe2+、H+与ClO-之间发生反应,在溶液中不能大量共存,故C错误;
D.NH4+、Ca2+、Cl-、K+之间不反应,都不与Fe3+反应,在溶液中不能大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题
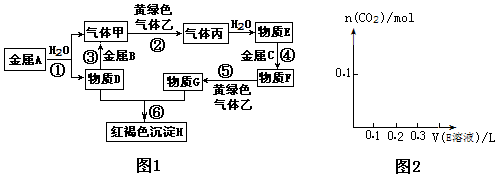
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气分子的电子式: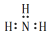 | B. | Mg2+结构示意图: | ||
| C. | 乙酸的结构简式:CH3COOH | D. | 乙醇的分子式C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-) | ||
| C. | c(NH4+)+c(H+)=c(Cl-)+c(OH-) | D. | c(NH4+)+c(NH3.H2O)=0.10mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
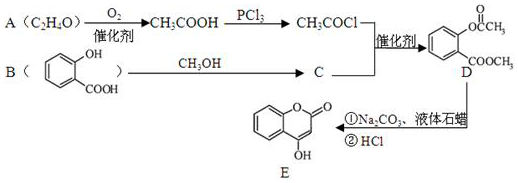
 .
.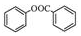 )的合成路线(无机原料任选).
)的合成路线(无机原料任选). .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
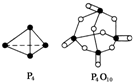 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.| 化学键 | P-P | P-O | O═O | P═O |
| 键能kJ/mol | 197 | 360 | 499 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 催化剂能使不起反应的物质发生反应 | |
| B. | 催化剂在化学反应前后,化学性质和质量都不变 | |
| C. | 催化剂能改变化学反应速率 | |
| D. | 任何化学反应,都需要催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L水所含分子数目为NA | |
| B. | 1mol•L-1 K2SO4溶液所含K+数目为2NA | |
| C. | 1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA | |
| D. | O2的摩尔体积约为22.4 L•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com