
【题目】一定条件下进行反应2X(g)+Y(g)![]() Z(s)+3W(g) ΔH<0。达到平衡后,t1时刻改变某一条件所得vt图像如图,则改变的条件为( )
Z(s)+3W(g) ΔH<0。达到平衡后,t1时刻改变某一条件所得vt图像如图,则改变的条件为( )

A. 增大压强B. 升高温度C. 加催化剂D. 增大生成物浓度
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g) ![]() CH3OH(g)达到平衡。下列说法正确的是( )
CH3OH(g)达到平衡。下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的正反应吸热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酯化反应的说法正确的是( )
A.醇与酸的反应都是酯化反应
B.酯化反应和中和反应原理一样
C.酯化反应既属于取代反应,也属于可逆反应
D.酯化反应的机理是羧酸去掉氢原子而醇去掉羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用H2O2和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:Cu(s) +2H+(aq) =Cu2+(aq) +H2(g) △H=64kJ/mol;2H2O2(l)=2H2O(l)+O2(g) △H= -196kJ/mol;H2(g)+1/2O2(g)=H2O(l) △H= -286kJ/mol.在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为___________。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0 mol/L的H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温 度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率×10-3mol.L-1.min-1 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______________。
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g) + O2(g)![]() 2SO3(g) ΔH = a kJ·mol-1,反应能量变化如图所示。下列说法中,不正确的是
2SO3(g) ΔH = a kJ·mol-1,反应能量变化如图所示。下列说法中,不正确的是

A.a<0
B.过程II可能使用了催化剂
C.使用催化剂可以提高SO2的平衡转化率
D.反应物断键吸收能量之和小于生成物成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在周期表中1~36号之间的W、X、Y、Z、Q五种元素,它们的原子序数依次增大, 已知W与其余四种元素既不同周期也不同主族;X和Z的基态原子的核外电子均排布在3个能级上,且均有2个未成对电子;Q元素原子质子数为29。
(1)按电子排布,Q元素在周期表中属____________区。
(2)第一电离能Y______Z,电负性Y______Z(填“>”,“=”或“<”)。
(3)W与Z形成的常见化合物有W2Z、W2Z2;W与Y能形成多种二元化合物,如YW3、Y2W4、Y3W5、Y4W6……,W2Z分子中Z原子的杂化类型为______,YW3分子的立体构型为_____,YW3极易溶于W2Z的主要原因有___________________。(写出两点即可)
(4)Q+基态核外电子排布式为________________________________。
(5)Q+与Y3-形成的晶胞结构如图所示,阴、阳离子间的核间距为 a pm,阿伏加德罗常数用NA 表示,则晶体的密度为_____________g·cm-3。
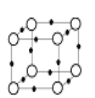
o-Y3- -Q+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某合作学习小组对物质进行的分类,正确的是
A. 冰、水混合是混合物B. 盐酸、食醋既是化合物又是酸
C. 不锈钢和我们日常生活中使用的硬币都是合金D. 纯碱和熟石灰都是碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格氏试剂RMgX由Mg和卤代烃RX在干燥下的乙醚中反应制得,广泛用于复杂有机物的合。下图是著名香料(![]() )的合成路线。
)的合成路线。

(1)写出反应Ⅰ的反应条件____,反应Ⅱ的反应类型为____,化合物C的名称是____。
(2)写出下列物质的结构简式: E____ , F____。
(3)写出苯 → C的化学方程式:____
(4)A有多种同分异构体,其中苯环上有两种化学环境氢的同分异构体(含-MgBr结构)有____种。
(5)设计原料(![]() )合成产物(
)合成产物( )的合成路线:____
)的合成路线:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属冶炼的说法正确的是
A. 炼铁高炉中所发生的反应都是放热的,故无需加热
B. 由于Al的活泼性强,故工业上采用电解熔融AlCl3的方法生产Al
C. 金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活泼性决定
D. 可以用钠加入氯化镁饱和溶液中制取镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com