
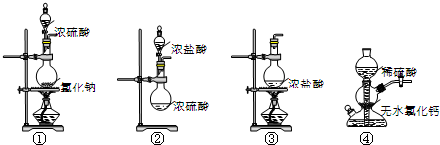
| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ①③④ |
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 断开lmol H-H键需要的能量大于断开1mol Cl-Cl键需要的能量 | |
| B. | 反应H2+C12=2HCl在光照和加热条件下的△H不同 | |
| C. | 反应①的活化能大于反应②的活化能 | |
| D. | 已知反应②的△H>O,则反应③的△H一定小于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 互为同分异构体 | B. | 均能与Na反应且产物相同 | ||
| C. | 均可发生取代反应和加成反应 | D. | 分子中共平面的碳原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| P>S | H->Li+ | KCl<Si | HClO3<HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
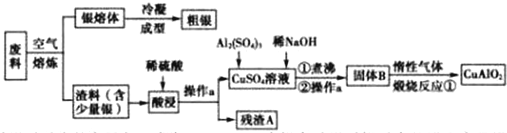
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳酸是一种氧化物 | |
| B. | 1个乳酸分子是由3个碳原子和3个水分子构成 | |
| C. | 葡萄糖与乳酸中所含的原子种类相同 | |
| D. | 葡萄糖不能为人体提供能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
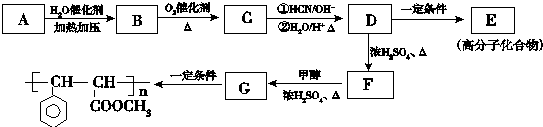
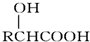
 .
. .
.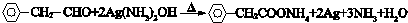 .
. .
.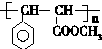 与足量氢氧化钠溶液反应的化学方程式
与足量氢氧化钠溶液反应的化学方程式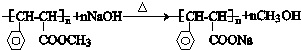 .
.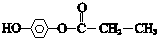 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com