
| A. | 小于90% | B. | 等于90% | C. | 大于90% | D. | 无法判断 |
分析 硅的近似相对原子质量为28.1,则硅元素的摩尔质量是28.1g/mol,再根据M=$\frac{m}{n}$计算其物质的量之比,利用物质的量之比求出含量.
解答 解:硅的近似相对原子质量为28.1,则硅元素的摩尔质量是28.1g/mol,
设${\;}_{14}^{28}$Si,${\;}_{14}^{29}$Si的物质的量分别是xmol、ymol,则$\frac{28g/mol×xmol+29g/mol×ymol}{(x+y)mol}$=28.1g/mol,
解得x:y=9:1,则${\;}_{14}^{28}$Si原子的含量的是$\frac{9}{9+1}$×100%=90%,故选B.
点评 本题考查相对原子质量的有关计算,难度不大,把握元素相对原子质量的定义及计算式为解答的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在元素周期表中,主族元素所在的族序数等于原子核外电子数 | |
| B. | 元素周期表有18个族 | |
| C. | ⅠA族的元素不全都是金属元素 | |
| D. | 短周期指的是一、二、三、四周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
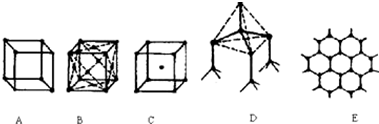
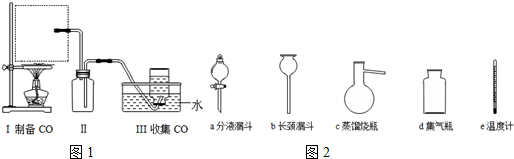
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前2 s 的平均速率v(CO)=0.080mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(Cl2)=“0.11“mol•L-1,则反应的△H<0 | |
| C. | T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,反应达到平衡前v正>v逆 | |
| D. | T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
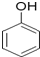 、
、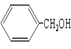 互为同系物
互为同系物| A. | ①②③④ | B. | 只有②③ | C. | 只有③④ | D. | 只有①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 装置图 |  |  | 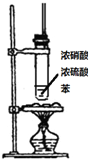 | 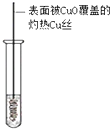 |
| 实验目的 | 分离乙酸乙酯、碳酸钠和水的混合物 | AgNO3验证苯与液溴发生取代反应 | 制备硝基苯 | 验证乙醇的还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
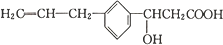 其可发生反应的类型有( )
其可发生反应的类型有( )| A. | ①②④⑤⑥⑦⑧ | B. | ①②③④⑤⑥⑦ | C. | ②③④⑤⑥⑦⑧ | D. | ①②③④⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 非金属之间形成的化学键不一定是共价键 | |
| C. | 含有共价键的化合物不一定是共价化合物 | |
| D. | 在共价化合物中也可能含有离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com