
 某品牌果冻标签如图所示.回答下列问题:
某品牌果冻标签如图所示.回答下列问题:分析 ①无机盐是无机酸根离子与金属离子形成的化合物;
②属于着色剂的是诱惑红和柠檬黄;能抑制细菌滋生的物质属于防腐剂;
③蔗糖水解生成葡萄糖和果糖.
解答 解:①无机盐是无机酸根离子与金属离子形成的化合物,所以属于无机盐的是KCl;
故答案为:KCl;
②属于着色剂的是诱惑红和柠檬黄;能抑制细菌滋生的物质属于防腐剂,则属于防腐剂的是山梨酸钾;
故答案为:柠檬黄;山梨酸钾;
③蔗糖水解生成葡萄糖和果糖,则蔗糖在人体内水解的化学方程式C12H22O11+H2O$\stackrel{催化剂}{→}$C6H12O6+C6H12O6;
故答案为:C12H22O11+H2O$\stackrel{酶}{→}$C6H12O6(葡萄糖)+C6H12O6(果糖).
点评 本题考查了化学知识在生产生活中的应用,题目难度不大,侧重于考查学生对基础知识的应用能力,注意把握蔗糖的水解反应方程式的书写方法.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,5.6L甲烷中的共价键数目 | |
| B. | 标准状况下,17gND3中所含分子数目 | |
| C. | 向0.2 mol NH4Al(SO4)2溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目 | |
| D. | 0.1mol羟基(-OH)中所含电子数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 65gKHSO4晶体中含有SO42-的数目为0.5NA | |
| B. | 把含0.1molFeCl3的浓溶液加入沸水中形成0.1NA个氢氧化铁胶体 | |
| C. | 常温常压下,7.0g乙烯与丙烯的混合物中含有碳氢键的数目为NA | |
| D. | 50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA | |
| B. | 常温常压下,3.0g乙烷中含有的碳氢键数为0.07NA | |
| C. | 250mL 1 mol•L-1H2SO4溶液中含有氧原子数为NA | |
| D. | 电解精炼铜时,当阳极溶解32g铜,则转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
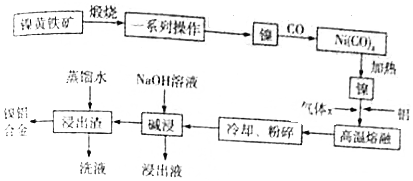
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
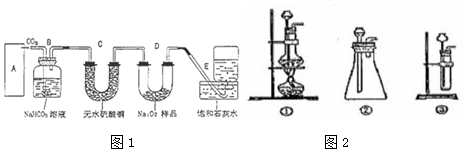
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com