
【题目】实验室常用H2O2制取O2,下列说法不正确的是( )
A.H2O2分子中含有极性键和非极性键
B.H2O分子中只含极性键
C.H2O2分子中所有原子都达到8电子稳定结构
D.该反应中H2O2是氧化剂也是还原剂
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学反应自发性的说法正确的是( )
A. 放热反应一定是自发进行的反应
B. 反应的自发性要综合考虑焓变和熵变两种因素
C. 化学反应的熵变与反应的方向无关
D. 只有不需要任何条件就能够自动进行的过程才是自发过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的绿色减排、捕捉、转化是人类可持续发展的重要战略之一。
(1)CO2来源之一是汽车尾气
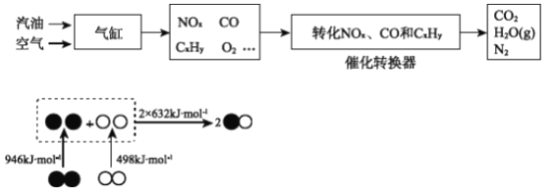

①根据上图,写出气缸内产生NO的热化学方程式________。
②写出转换器中在催化剂作用下NOx和CO反应的化学方程式________。
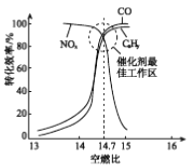
③在催化转换器中机动车尾气转化效率与空燃比(空气与燃油气的体积比)的关系如右图。若空燃比小于14.7,氧气不足,CxHy和CO不能被完全氧化,导致其转化效率降低;若空燃比大于14.7,则NOx的转化效率降低,原因是________。
(2)利用NaOH溶液可以“捕捉” CO2
已知:0.448L CO2(已折算标准状况)被NaOH溶液充分吸收,得到100mL含有Na2CO3和NaHCO3的吸收液。
①向吸收液中加入足量BaCl2溶液得到沉淀,经过滤、洗涤、干燥后,称重为1.97g,则吸收液中c(Na2CO3) = ________。(该条件下NaHCO3与BaCl2不反应)
②对该吸收液,下列判断正确的是________。
a . c (CO32- ) > c (HCO3- )
b. 2c (CO32- ) + c (HCO3- ) + c (OH- ) = c (H+ ) + c (Na+ )
c. c (H2CO3) + c (HCO3- ) + c (CO32- ) =0.2molL-1
(3)工业上可用CO2来制甲醇
①CO2 (g) + 3H2(g) ![]() CH3OH(g) + H2O(g) ΔH < 0
CH3OH(g) + H2O(g) ΔH < 0
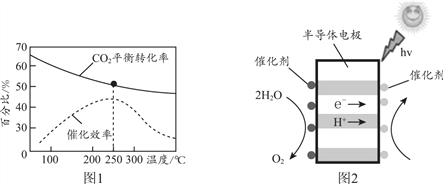
根据图1分析,实际工业生产中,反应温度选择250℃的理由________。
②利用光电催化原理,由CO2和H2O制备CH3OH的装置如图2。写出右侧的电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质所发生的化学反应中,由于反应物的用量不同而得到不同产物的是( )
①铁与稀硝酸②碳酸钠溶液与稀盐酸③铝和NaOH溶液④铁与氯气
A.①②B.①②③④C.①③D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1032molL﹣1 HCl溶液滴定未知浓度的NaOH溶液,
(1)某同学按下列步骤进行实验:①取一锥形瓶,用待测NaOH溶液润洗两次; ②在锥形瓶中加入 25,.00 mL待测NaOH溶液;③加入几滴石蕊试剂做指示剂;④取一支酸式滴定管,洗涤干净; ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定; ⑥两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点.
其中所述操作有错误的序号为
(2)取用25.00 mL待测NaOH溶液应用以下(选填:“甲”、“乙”)装置,若取用NaOH溶液开始平视读数、结束时俯视读数,会导致所测氢氧化钠溶液浓度(填“偏大““偏小“或“不变“) ![]()
(3)若滴定开始前滴定管尖嘴中有一气泡,滴定结束后气泡消失, 则会导致所测氢氧化钠溶液浓度(填“偏大““偏小“或“不变“)
(4)若平行实验三次,记录的数据如下表
滴定次数 | 待测溶液的体积(/mL) | 标准HCl溶液的体积 | |
滴定前读数(/mL) | 滴定后读数(/mL) | ||
① | 25.00 | 1.02 | 21.04 |
② | 25.00 | 2.00 | 22.98 |
③ | 25.00 | 0.20 | 20.18 |
试计算待测NaOH溶液的物质的量浓度(列出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:NO(g)+CO(g) ![]() N2+CO2(g)△H=﹣373.4kJ/mol在一容积为5L的恒容密闭容器中充人0.2mol NO和0.5mol CO,5min后该反应达到平衡,此时N2的物质的量为0.06mol.下列说法正确的是( )
N2+CO2(g)△H=﹣373.4kJ/mol在一容积为5L的恒容密闭容器中充人0.2mol NO和0.5mol CO,5min后该反应达到平衡,此时N2的物质的量为0.06mol.下列说法正确的是( )
A.达到平衡后,若只升高温度,化学平衡正向移动
B.达到平衡后,再通人稀有气体,逆反应速率增大
C.使用催化剂,平衡常数不变
D.0~5min内,NO的反应速率为2.4×10﹣3molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化物与 NaOH 溶液反应生成易溶于水的化合物 M,将少量 M 溶液滴入稀盐酸中,有白色沉淀产生,则该氧化物是
A.Fe2O3B.SiO2C.A12O3D.MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】春秋季节在我市常出现大雾天气,对于这种现象下列说法正确的是
A.大雾是由于空气中的SO2超标造成的
B.大雾可看作是一种分散剂为水的分散系
C.大雾可看作是一种胶体
D.大雾是由于空气中的粉尘超标造成的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com