
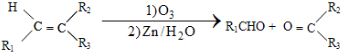
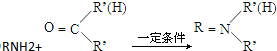
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$  +H2O;
+H2O; ;
; ,(写出其中的一种的结构简式).
,(写出其中的一种的结构简式).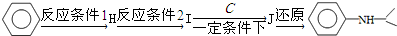
 .
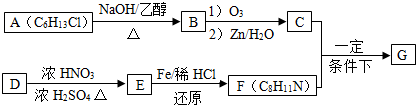
. 分析 A的分子式为C6H13Cl,为己烷的一氯代物,在氢氧化钠醇溶液、加热条件下发生消去反应得到B为烯烃,1mol B发生信息①中氧化反应生成2mol C,且C不能发生银镜反应,B为对称结构烯烃,且不饱和C原子没有H原子,故B为(CH3)2C=C(CH3)2,C为(CH3)2C=O,逆推可知A为(CH3)2CH-CCl(CH3)2.D属于单取代芳烃,其相对分子质量为106,D含有一个苯环,侧链式量=106-77=29,故侧链为-CH2CH3,D为 ,核磁共振氢谱显示F苯环上有两种化学环境的氢,故D发生乙基对位取代反应生成E为
,核磁共振氢谱显示F苯环上有两种化学环境的氢,故D发生乙基对位取代反应生成E为 ,由F的分子式可知,E中硝基被还原为-NH2,则F为
,由F的分子式可知,E中硝基被还原为-NH2,则F为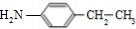 ,C与F发生信息⑤中反应,分子间脱去1分子水形成N=C双键得到G,则G为
,C与F发生信息⑤中反应,分子间脱去1分子水形成N=C双键得到G,则G为 ,据此解答.
,据此解答.
解答 解:A的分子式为C6H13Cl,为己烷的一氯代物,在氢氧化钠醇溶液、加热条件下发生消去反应得到B为烯烃,1mol B发生信息①中氧化反应生成2mol C,且C不能发生银镜反应,B为对称结构烯烃,且不饱和C原子没有H原子,故B为(CH3)2C=C(CH3)2,C为(CH3)2C=O,逆推可知A为(CH3)2CH-CCl(CH3)2.D属于单取代芳烃,其相对分子质量为106,D含有一个苯环,侧链式量=106-77=29,故侧链为-CH2CH3,D为 ,核磁共振氢谱显示F苯环上有两种化学环境的氢,故D发生乙基对位取代反应生成E为
,核磁共振氢谱显示F苯环上有两种化学环境的氢,故D发生乙基对位取代反应生成E为 ,由F的分子式可知,E中硝基被还原为-NH2,则F为
,由F的分子式可知,E中硝基被还原为-NH2,则F为 ,C与F发生信息⑤中反应,分子间脱去1分子水形成N=C双键得到G,则G为
,C与F发生信息⑤中反应,分子间脱去1分子水形成N=C双键得到G,则G为 .
.
(1)由A生成B的化学方程式为:(CH3)2CH-CCl(CH3)2+NaOH$→_{△}^{乙醇}$(CH3)2C=C(CH3)2+NaCl+H2O,属于消去反应,
故答案为:(CH3)2CH-CCl(CH3)2+NaOH$→_{△}^{乙醇}$(CH3)2C=C(CH3)2+NaCl+H2O;消去反应;
(2)由上述分析可知,E为 ,化学名称是对硝基乙苯,由D生成E的化学方程式为:
,化学名称是对硝基乙苯,由D生成E的化学方程式为: +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$  +H2O,
+H2O,
故答案为:对硝基乙苯; +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$  +H2O;
+H2O;
(3)由上述分析可知,G的结构简式为 ,
,
故答案为: ;
;
(4)F为 ,含有苯环同分异构体中,
,含有苯环同分异构体中,
若取代基为氨基、乙基,还有邻位、间位2种,
若只有一个取代基,可以为-CH(NH2)CH3、-CH2CH2NH2、-NH-CH2CH3、-CH2NHCH3、-N(CH3)2,有5种;
若取代为2个,还有-CH3、-CH2NH2或-CH3、-NHCH3,各有邻、间、对三种,共有6种;
若取代基有3个,即-CH3、-CH3、-NH2,2个甲基相邻,氨基有2种位置,2个甲基处于间位,氨基有3种位置,2个甲基处于对位,氨基有1种位置,共有2+3+1=6种,
故符合条件的同分异构体有:2+5+6+6=19,
其中核磁共振氢谱为4组峰,且面积比为6:2:2:1,说明含有2个-CH3,可以是 ,
,
故答案为:19; ;
;
(5)由苯与浓硝酸、浓硫酸在加热条件下得到H为硝基苯,硝基苯在Fe粉/盐酸条件下还有得到I为 ,再与(CH3)2C=O反应得到
,再与(CH3)2C=O反应得到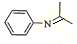 ,最后加成反应还原得到
,最后加成反应还原得到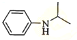 ,
,
故反应条件1所选用的试剂为:浓硝酸、浓硫酸,反应条件2所选用的试剂为:Fe粉/稀盐酸,I的结构简式为  ,
,
故答案为:浓硝酸、浓硫酸;Fe粉/盐酸; .
.
点评 本题考查有机物推断与合成,需要学生对给予的信息进行运用,能较好的考查学生自学能力,要充分利用合成路线中有机物的分子式,关键是确定A与D的结构,再利用正、逆推法相结合进行推断,(4)中同分异构体问题为易错点,难度中等.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | B. | 原子半径:Na<Mg<Al | ||
| C. | 金属性:Na<Mg<Al | D. | 单质的还原性:Al>Mg>Na |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
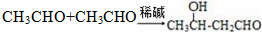
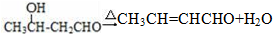
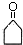 .
.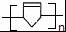 .
.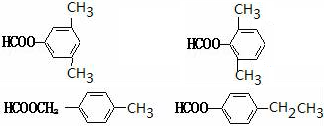 任意2种.
任意2种.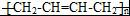 ).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓硫酸}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$
).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓硫酸}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$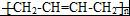 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
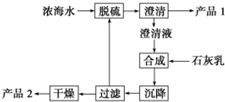 海水淡化及海水资源的提取利用是当今化工行业重要课题.
海水淡化及海水资源的提取利用是当今化工行业重要课题.| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A与C可形成共价化合物 | |
| B. | A的简单氢化物的稳定性大于C的简单氢化物的稳定性 | |
| C. | 原子半径:A<B<C | |
| D. | B的氧化物的熔点比A的最高价氧化物熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 用途 | 解释 |
| A | 晶体硅 | 高纯硅广泛应用于光导纤维、太阳能电池和计算机芯片 | 硅具有半导体性能 |
| B | 氧化铝 | 制作耐高温材料 | Al2O3熔点很高 |
| C | 硫酸钡 | 医学上用做钡餐 | Ba2+无毒 |
| D | 明矾 | 作消毒剂 | 明矾水解产生具有吸附性的胶体粒子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X、Y、Z原子的核外最外层电子数的总和为22 | |
| B. | 上述四种元素的原子半径大小为W<X<Y<Z | |
| C. | 有W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| D. | W与Y可形成既含极性共价键又含非极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
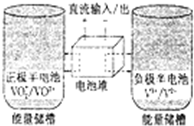 全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )
全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )| A. | 放电时,右槽发生还原反应 | |
| B. | 放电时,左槽的电极反应式:VO2++2H++e-═VO2++H2O | |
| C. | 充电时,每转移1mol电子,n(H+)的变化量为1mol | |
| D. | 充电时,阴极电解液pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H3PO4 | B. | Na3PO4 | C. | Ag | D. | Na2HPO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com