
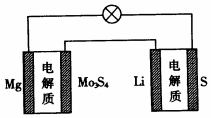
 已知:镁电池的总反应为xMg+Mo3S4$?_{放电}^{充电}$MgxMo3S4,锂硫电池的总反应为2Li+S$?_{放电}^{充电}$Li2S.下列说法正确的是( )
已知:镁电池的总反应为xMg+Mo3S4$?_{放电}^{充电}$MgxMo3S4,锂硫电池的总反应为2Li+S$?_{放电}^{充电}$Li2S.下列说法正确的是( )| A. | 镁电池放电时,Mg2+向负极迁移 | |
| B. | 镁电池放电时,正极发生的电极反应为Mo3S4+2xe-=Mo3S42- | |
| C. | 理论上两种电池的比能量相同(参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量) | |
| D. | 图中Li作负极,Mo3S4作阳极 |
分析 A.原电池中阳离子向正极移动;
B.原电池中正极发生还原反应,得电子化合价降低;
C.比能量是参与电极反应的单位质量的电极材料放出电能的大小;
D.多池相连,含活泼强的电极为原电池,其它电池为电解池.
解答 解:A.原电池中阳离子向正极移动,则镁电池放电时,Mg2+向正极迁移,故A错误;
B.原电池中正极发生还原反应,得电子化合价降低,所以正极发生的电极反应为Mo3S4+2xe-=Mo3S42-,故B正确;
C.比能量是参与电极反应的单位质量的电极材料放出电能的大小,锂硫电池放电时负极为Li,镁电池放电时负极为镁,两种电池的负极材料不同,所以比能量不同,故C错误;
D.多池相连,含活泼强的电极为原电池,其它电池为电解池,活泼强的是锂,所以右边是原电池,左边是电解池,锂是负极,与之相连的Mo3S4作阴极,故D错误;
故选B.
点评 本题考查了二次电池,为高频考点,侧重于对原电池原理和电解池原理的考查,题目难度中等,注意根据电池总反应判断正负极材料及电极反应.


科目:高中化学 来源: 题型:选择题
| A. | Si与SiO2在常温下都可与NaOH溶液反应 | |
| B. | C与SiO2之间可以反应制备Si,同时得到CO | |
| C. | Si与SiO2都可以与氢氟酸反应 | |
| D. | Si→SiO2→H2SiO3可以通过一步反应实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
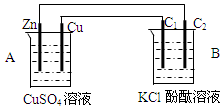 按图装置进行实验,并回答下列问题
按图装置进行实验,并回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 颜色 | 水中溶解性 |
| Fe2S3 | 黑色 | 难溶于水 |
| FeS | 黑褐色 | 难溶于水 |
| 实验步骤 | 操作 | 现象 | 备注 |
| 1 | 向2mL 0.1mol/L氯化铁溶液中逐滴滴入3滴0.1mol/L 硫化钠溶液 | 产生黑色沉淀,立即变为黄色沉淀,未见其它明显现象 | 自始至终都未见红褐色沉淀 |
| 2 | 继续滴加3滴0.1mol/L 硫化钠溶液 | 同上 | |
| 3 | 继续滴加0.1mol/L 硫化钠溶液至过量 | 产生黑色沉淀,振荡后静置,未发现明显变化 |
| 实验步骤 | 操作 | 现象 |
| 4 | 向2mL 0.1mol/L硫化钠溶液中逐滴滴入3滴0.1mol/L 氯化铁溶液 | 产生黑色沉淀,未见其它明显现象 |
| 5 | 继续滴加3滴0.1mol/L 氯化铁溶液 | 同上 |
| 6 | 继续滴加0.1mol/L 氯化铁溶液至过量 | 同上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
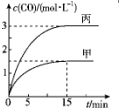 一定条件下存在反应C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、丙两个恒容容器中加入一定量C和H2O(g),向乙恒容容器中加入一定量CO和H2,各容器中温度、反应物的起始量如表,甲、丙反应过程中CO的物质的量浓度随时间变化如图.
一定条件下存在反应C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、丙两个恒容容器中加入一定量C和H2O(g),向乙恒容容器中加入一定量CO和H2,各容器中温度、反应物的起始量如表,甲、丙反应过程中CO的物质的量浓度随时间变化如图.| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2mol C、 1mol H2O(g) | 1mol CO、 1mol H2 | 4mol C、 2mol H2O(g) |
| A. | 丙容器的容积V<0.5L | |
| B. | 甲容器中,反应在前15 min内的平均反应速率v(H2)=0.15 mol•L-1•min-1 | |
| C. | 当温度为T1℃时,反应的平衡常数K=2.25 | |
| D. | 乙容器中,若平衡时n(H2O)=0.3 mol,则T1<T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气属于化石能源,太阳能、氢能、风能、地热能、海洋能属于新能源 | |
| B. | 白铁(镀锌铁板)比马口铁(镀锡铁板)更耐腐蚀 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应采取深度填埋法 | |
| D. | 测试和调控溶液的pH对工农业生产、科学研究及日常生活和医疗保健都有重要意义 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com