
ŃŠ¾æ±ķĆ÷£ŗ¶ąÖÖŗ£²śĘ·ČēĻŗ”¢Š·”¢ÄµņĆµČ£¬ĢåÄŚŗ¬ÓŠ+5¼ŪÉé£ØAs£©ŌŖĖŲ£¬µ«Ėü¶ŌČĖĢåŹĒĪŽ¶¾µÄ£¬ÅųĖŖµÄ³É·ÖŹĒAs2O3£¬Źō¾ē¶¾ĪļÖŹ£¬×ؼŅÖŅøę£ŗ³Ō·¹Ź±²»ŅŖĶ¬Ź±“óĮæŹ³ÓĆŗ£ĻŹŗĶĒą²Ė£¬·ńŌņČŻŅ×ÖŠ¶¾£¬²¢øų³öĮĖŅ»øö¹«Ź½£ŗ“óĮæŗ£ĻŹ+“óĮæĪ¬ÉśĖŲC=ÅųĖŖ£®ĻĀĆęÓŠ¹Ų½āŹĶ²»ÕżČ·µÄŹĒ£Ø””””£©
”” A£® Ī¬ÉśĖŲCÄܽ«+5¼ŪÉéŃõ»Æ³ÉAs2O3
”” B£® Ī¬ÉśĖŲC¾ßÓŠ»¹ŌŠŌ
”” C£® ÖĀČĖÖŠ¶¾¹ż³ĢÖŠ+5¼ŪÉé·¢Éś»¹Ō·“Ó¦
”” D£® Ēą²ĖÖŠŗ¬ÓŠĪ¬ÉśĖŲC
æ¼µć£ŗ Ńõ»Æ»¹Ō·“Ó¦£®
×ØĢā£ŗ Ńõ»Æ»¹Ō·“Ó¦×ØĢā£®
·ÖĪö£ŗ ČĖĢåÖŠµÄAsŌŖĖŲĪŖ+5¼Ū£¬As2O3ÖŠAsŌŖĖŲĪŖ+3¼Ū£¬³Ō·¹Ź±Ķ¬Ź±“óĮæŹ³ÓĆŗ£ĻŹŗĶĒą²Ė£¬ČŻŅ×ÖŠ¶¾µÄŌŅņŹĒÉś³É+3¼ŪAs£¬ĖµĆ÷Ī¬ÉśĖŲC¾ßÓŠ»¹ŌŠŌ£¬Óė+5¼ŪÉé·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³É+3¼ŪAs£®
½ā“š£ŗ ½ā£ŗČĖĢåÖŠµÄAsŌŖĖŲĪŖ+5¼Ū£¬As2O3ÖŠAsŌŖĖŲĪŖ+3¼Ū£¬³Ō·¹Ź±Ķ¬Ź±“óĮæŹ³ÓĆŗ£ĻŹŗĶĒą²Ė£¬ČŻŅ×ÖŠ¶¾µÄŌŅņŹĒÉś³É+3¼ŪAs£¬
ĖµĆ÷Ī¬ÉśĖŲC¾ßÓŠ»¹ŌŠŌ£¬Óė+5¼ŪÉé·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³É+3¼ŪAs£¬Ōņ
A£®Ī¬ÉśĖŲC¾ßÓŠ»¹ŌŠŌ£¬Óė+5¼ŪÉé·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³É+3¼ŪAs£¬¹ŹA“ķĪó£»
B£®ČĖĢåÖŠµÄAsŌŖĖŲĪŖ+5¼Ū£¬“óĮæŹ³ÓĆŗ£ĻŹŗĶĒą²ĖŗóÉś³É+3¼ŪAs£¬ĖµĆ÷Ī¬ÉśĖŲC¾ßÓŠ»¹ŌŠŌ£¬¹ŹBÕżČ·£»
C£®+5¼ŪÉéÉś³É+3¼ŪAs£¬»ÆŗĻ¼Ū½µµĶ£¬µĆµē×Ó±»»¹Ō£¬ĪŖ»¹Ō·“Ó¦£¬¹ŹCÕżČ·£»
D£®Ī¬ÉśĖŲC¾ßÓŠ»¹ŌŠŌ£¬Óė+5¼ŪÉé·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³É+3¼ŪAs£¬Ķ¬Ź±“óĮæŹ³ÓĆŗ£ĻŹŗĶĒą²Ė£¬ČŻŅ×ÖŠ¶¾£¬ĖµĆ÷Ēą²ĖÖŠŗ¬ÓŠĪ¬ÉśĖŲC£¬¹ŹDÕżČ·£®
¹ŹŃ”A£®
µćĘĄ£ŗ ±¾Ģāæ¼²éŃõ»Æ»¹Ō·“Ó¦£¬ĢāÄæÄŃ¶Č²»“ó£¬×¢Ņā“Ó»ÆŗĻ¼Ū±ä»ÆµÄ½Ē¶Č·ÖĪöŃõ»Æ»¹Ō·“Ó¦£®


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠø÷×éÓŠ»śĪļÖŠ£¬Ö»Šč¼ÓČėäåĖ®¾ĶÄÜŅ»Ņ»¼ų±šµÄŹĒ( )
A£®¼ŗĻ©”¢±½”¢ĖÄĀČ»ÆĢ¼ B£®±½”¢¼ŗČ²”¢¼ŗĻ©
C£®¼ŗĶ锢±½”¢»·¼ŗĶé D£®¼×±½”¢¼ŗĶ锢¼ŗĻ©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ(””””)
A£®ĢśµÄÓ¦ÓĆ¾ĄśĮĖ”°Ģś”ŖĘÕĶØøÖ”Ŗ²»ŠāøÖµČĢŲÖÖøÖ”±µÄŃŻ±ä¹ż³Ģ
B£®¼õÉŁÉśĢśĄļµÄĢ¼ŌŖĖŲ£¬²¢Ōö¼Ó¹č”¢ĆĢµČŌŖĖŲ£¬¼“×Ŗ»ÆĪŖøÖ
C£®ĘÕĶØøÖÖŠµÄŗ¬øõĮæŅ»°ćŌŚ12%ŅŌÉĻ
D£®²»ŠāøÖŹĒŌŚĘÕĶØøֵĻł“”ÉĻ£¬¼ÓČėøõ”¢ÄųµČ¶ąÖÖŌŖĖŲĮ¶³ÉµÄøÖ²Ä
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĪļÖŹÖŠ²»ŹōÓŚŗĻ½šµÄŹĒ£Ø””””£©
A£®Ó²ĀĮ B£®øÖĢś C£®ĒąĶ D£®½š²
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
£Ø1£©»ĘĢśæó£ØFeS2£©ŹĒÉś²śĮņĖįŗĶŅ±Į¶øÖĢśµÄÖŲŅŖŌĮĻ£®ĘäÖŠŅ»øö·“Ó¦ĪŖ3FeS2+8O2£½6SO2+Fe3O4£¬Ńõ»Æ²śĪļĪŖ £¬ČōÓŠ3mol FeS2²Ī¼Ó·“Ó¦£¬×ŖŅĘ molµē×Ó”£
£Ø2£©ÓėĆ÷·ÆĻąĖĘ£¬ĮņĖįĢśŅ²æÉÓĆ×÷¾»Ė®¼Į£¬ĘäŌĄķĪŖ £ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©”£
£Ø3£©FeCl3ÓėĒāµāĖį·“Ó¦Ź±æÉÉś³É×ŲÉ«ĪļÖŹ£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
£Ø4£©ŌŚČȵÄĻ”ĮņĖįČÜŅŗÖŠČܽāŅ»¶ØĮæµÄFeSO4ŗó£¬ŌŁ¼ÓČė×ćĮæµÄKNO3ČÜŅŗ£¬æÉŹ¹ĘäÖŠµÄFe2+Č«²æ×Ŗ»Æ³ÉFe3+£¬²¢ÓŠĪŽÉ«ĘųĢåŅŻ³ö£¬ĒėŠ“³öĻąÓ¦µÄĄė×Ó·½³ĢŹ½£ŗ ”£
£Ø5£©ĢśŗģŹĒŅ»ÖÖŗģÉ«ŃÕĮĻ£¬Ęä³É·ÖŹĒFe2O3½«Ņ»¶ØĮæµÄĢśŗģČÜÓŚ160mL 5mol•L-1ŃĪĖįÖŠ£¬ŌŚ¼ÓČėŅ»¶ØĮæĢś·ŪĒ”ŗĆČܽā£¬ŹÕ¼Æµ½2.24L£Ø±ź×¼×“æö£©£¬Ķł·“Ó¦ŗóČÜŅŗÖŠµĪ¼ÓKSCNČÜŅŗ£¬ĪŽĆ÷ĻŌĻÖĻó£¬Ōņ²Ī¼Ó·“Ó¦µÄĢś·ŪµÄÖŹĮæĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ÖŠÕżČ·µÄŹĒ£Ø””””£©
”” A£® ÄĘÓėĖ®·“Ó¦£ŗ2Na+2H2O=2Na++2OH©+H2”ü
”” B£® ĒāŃõ»Æ±µČÜŅŗŗĶĮņĖįļ§ČÜŅŗ·“Ó¦£ŗBa2++SO42©=BaSO4”ż
”” C£® Įņ»ÆÄĘČÜÓŚĖ®³Ź¼īŠŌ£ŗS2©+2H2O⇌H2S+2OH©
”” D£® Ļņäå»ÆŃĒĢśČÜŅŗÖŠĶØČėÉŁĮæĀČĘų£ŗCl2+2Br©=2Cl©+Br2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠø÷×éĄė×ÓŌŚČÜŅŗÖŠÄÜ“óĮæ¹²“ęµÄŹĒ£Ø””””£©
| ”” | A£® | Fe3+”¢SCN©”¢Na+”¢Cl© | B£® | Cl©”¢AlO2©”¢HCO3©”¢Na+ |
| ”” | C£® | Fe2+”¢NH4+”¢SO42©”¢S2© | D£® | Ca2+”¢HCO3©”¢Cl©”¢K+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠÓŠ¹Ų½šŹōøÆŹ“Óė·Ą»¤µÄĖµ·ØÕżČ·µÄŹĒ
A£®ŌŚĢśĆÅÉĻŗø½ÓĶæéÄÜ·ĄøÆŹ“
B£®¶ĘĪżĢśÖĘĘ·µÄ¶Ę²ćĘĘĖšŗó£¬¶Ę²ćČŌÄܶŌĢśÖĘĘ·Ęš±£»¤×÷ÓĆ
C£®øÖÖłŌŚĖ®ĻĀ²æ·Ö±ČŌŚæÕĘųÓėĖ®½»½ē“¦øüČŻŅ×øÆŹ“
D£®ŌŚŗ£ĀÖĶāæĒĮ¬½ÓŠææ飬±£»¤ĶāæĒ²»ŹÜøÆŹ“ŹĒ²ÉÓĆĮĖĪžÉüŃō¼«µÄŅõ¼«±£»¤·Ø
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
¼īŹ½ĮņĖįĢśFe(OH)SO4¶ŌĖ®ÖŠµÄŠüø”Īļ”¢ÓŠ»śĪļ”¢Įņ»ÆĪļ”¢ÖŲ½šŹōµČ¶¼ÄÜŠõÄż£¬¹¤ŅµÉĻ³£ÓĆĮņĖįŃĒĢś·ØÖʱø£¬¹¤ŅÕĮ÷³ĢČēĻĀĶ¼ĖłŹ¾£ŗ
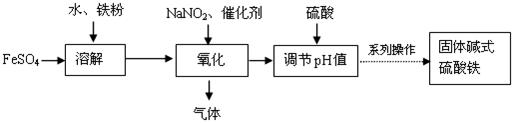
ŅŃÖŖ£ŗ Fe3+³ĮµķĶźČ«Ź±µÄpH£½3.1£¬ Fe2+³ĮµķĶźČ«Ź±µÄpH£½9.7”£
£Ø1£©ĒėŠ“³öČܽā¹ż³ĢÖŠ¼ÓæģČܽāĖŁĀŹŗĶĢįøß½ž³öĀŹµÄĮ½µć“ėŹ©£ŗ
_______________________________£¬______________________________”£
£Ø2£©¼ÓČėĮņĖįµÄ×÷ÓĆŹĒæŲÖĘĢåĻµµÄpHÖµ£¬ČōĮņĖį¼ÓČėĮæ¹żŠ”£¬·“Ó¦ĢåĻµĖį¶ČĢ«µĶ£¬ČŻŅ×Éś³É ³Įµķ£»ČōĮņĖį¼ÓČėĮæ¹ż“󣬲»ĄūÓŚ²śĘ·ŠĪ³É£¬ŹŌ“ÓĘ½ŗāŅĘ¶ÆµÄ½Ē¶Č·ÖĪöŌŅņŹĒ ”£
£Ø3£©Ńõ»Æ¹ż³ĢÖŠÉś³ÉµÄĘųĢåÓöæÕĘų±äŗģ×ŲÉ«”£Š“³öŃõ»Æ¹ż³Ģ·¢ÉśµÄĄė×Ó·½³ĢŹ½£ŗ
________________________________________________________________ӣ
£Ø4£©Į÷³ĢĶ¼ÖŠµÄ”°ĻµĮŠ²Ł×÷”±°üĄØ £¬ £¬¹żĀĖ£¬Ļ“µÓ£¬ŗęøÉ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com