
下列说法正确的是( )
A.在一定条件下,乙烯能与H2发生加成反应,苯不能与H2发生加成反应
B.C2H6O和C4H10都有2种同分异构体
C.乙酸乙酯、乙酸均能与NaOH反应,二者分子中官能团相同
D.淀粉和蛋白质均可水解生成葡萄糖
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物:
CH4 (g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-570 kJ·mol-1
CH4(g)+4NO(g)===2 N2(g) +CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
请写出CH4 与NO2生成无毒气体的热化学方程式:
_________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习兴趣小组讨论辨析以下说法,其中说法正确的是( )
①通过化学变化可以实现16O与18O间的相互转化
②灼烧钠的化合物时,火焰呈黄色,发生化学反应
③碱性氧化物一定是金属氧化物
④只由一种元素组成的物质一定为纯净物
⑤石墨和C60是同素异形体
⑥糖类、蛋白质、油脂属于天然高分子化合物
A.③⑤⑥ B.①② C.③⑤ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
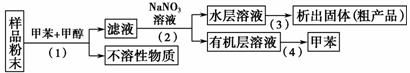
下列说法错误的是( )
A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量。
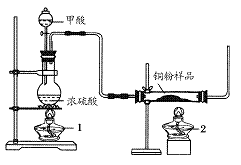
(1)制备一氧化碳的化学方程式是___________________。
(2)实验中,观察到反应管中发生的现象是_____________;尾气的主要成分是_________。
(3)反应完成后,正确的操作顺序为________(填字母)
a.关闭漏斗开关 b.熄灭酒精灯1 c.熄灭酒精灯2
(4)若实验中称取铜粉样品10.0 g,充分反应后,反应管中剩余固体的质量为9.6 g,则原样品中单质铜的质量分数为________。
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的最佳方案:
①设计方案的主要步骤是(不必描述操作过程的细节)__________;
②写出有关反应的化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对铜—锌—稀硫酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是①锌片溶解了32.5克 ②锌片增重了32.5克 ③铜片上析出1克氢气④铜片上析出1mol氢气
A. ①③ B.①④ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:
n(A)=n(B)=________mol;
(2)B的平均反应速率v(B)=________mol/(L·min);
(3)x的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
医用氯化钙可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—103.0%),工艺流程为:
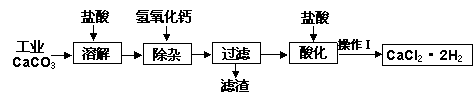
生产二水合氯化钙的主要流程
(1)CaCO3与盐酸反应的离子方程式 。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:① ,
②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括 、 、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 (只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因
之一为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com