
| A. | C、H、O | B. | F、Cl、Br | C. | Li、Be、B | D. | Si、S、P |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCHO | B. | CH3CHO | C. | CH3CH2CHO | D. | CH3CH2CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制普通玻璃的主要原料是纯碱、石灰石、石英 | |
| B. | 氨是制作氮肥、硝酸、铵盐的重要原料 | |
| C. | 将氢气和氯气混合光照生成氯化氢,溶于水制得盐酸 | |
| D. | 制造普通水泥的主要原料是黏土、石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液的pH不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液的pH减小 | |
| C. | 电解氯化钾溶液,在阴极上和阳极上析出的产物的物质的量之比为1:1 | |
| D. | 电解硫酸钠溶液,在阴极上和阳极上析出的产物的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
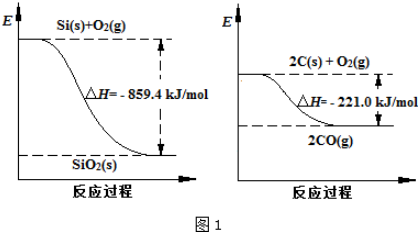
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com