
| A、M mol?L-1 | ||
| B、2M mol?L-1 | ||
C、
| ||
| D、无法确定 |
| n |
| V |
| AM×10 -3mol |
| 2A×10 -3L |
| M |
| 2 |


科目:高中化学 来源: 题型:
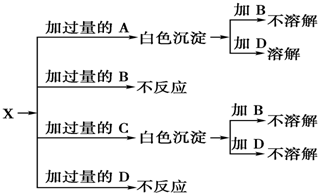
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaBH4是氧化剂,H2O是还原剂 |
| B、被氧化的元素与被还原的元素质量比为1:1 |
| C、硼元素被氧化,氢元素被还原 |
| D、NaBH4既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
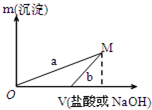 某同学设计了两种方案制备氢氧化铝.
某同学设计了两种方案制备氢氧化铝.| 100mL稀盐酸 |
| NaOH溶液 |
| 100mLNaOH溶液 |
| 稀盐酸 |
| A、a曲线表示的是向X溶液中加入NaOH溶液 |
| B、在M点时,两种方案中所得溶液的溶质质量分数相同 |
| C、方案二比方案一生成更多的气体 |
| D、M点以后,a、b两条曲线将重合为一条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
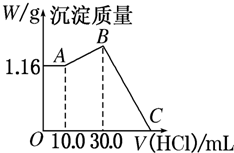 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐滴加入1.00mol?L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐滴加入1.00mol?L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
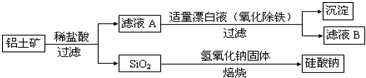
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸不慎沾在皮肤上,应立即用大量水冲洗,再涂上3%~5%的小苏打溶液 |
| B、给试管里的液体加热时,试管应与桌面垂直 |
| C、配制一定物质的量浓度的NaCl溶液时,定容、振荡、摇匀后,发现液面低于刻度线,再加水到刻度线 |
| D、将pH试纸用蒸馏水润湿后,测定稀盐酸的pH值 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com