
| A. | 水电离的H+浓度c(H+)=10-12mol•L-1的溶液中:Cl-、CO32-、NO3-、NH4+、SO32- | |
| B. | 使石蕊变红的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42- | |
| C. | 加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42- | |
| D. | 中性溶液中:Fe3+、Al3+、NO3-、I-、Cl-、S2- |
分析 A.水电离的H+浓度c(H+)=10-12mol•L-1的溶液可能呈酸性或碱性;
B.使石蕊变红的溶液呈酸性;
C.加入Mg能放出H2的溶液呈酸性;
D.能水解的离子不能大量存在于中性溶液中.
解答 解:A.水电离的H+浓度c(H+)=10-12mol•L-1的溶液可能呈酸性或碱性,酸性条件下CO32-、SO32-不能大量共存,碱性条件下NH4+不能大量共存,故A错误;
B.使石蕊变红的溶液呈酸性,酸性条件下Fe2+与MnO4-、NO3-发生氧化还原反应,不鞥大量共存,故B错误;
C.加入Mg能放出H2的溶液呈酸性,酸性条件下离子之间不发生任何反应,可大量共存,故C正确;
D.Fe3+、Al3+水解呈酸性,S2-水解呈碱性,发生互促水解而不能大量存在于中性溶液中,且Fe3+、I-发生氧化还原反应,故D错误.
故选C.
点评 本题考查离子共存问题,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握常见离子的性质以及反应类型的判断,答题时注意审题,把握溶液离子成分和性质,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此时水的电离程度最大 | |
| B. | 溶液中c(NH${\;}_{4}^{+}$)=c(Cl-) | |
| C. | 此时溶液中NH3•H2O的物质的量浓度为$\frac{1}{2}$(a-0.01)mol/L | |
| D. | 用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,CH3OH参与反应的电极为正极 | |
| B. | 放电时,每通入标况下11.2L O2完全反应转移电子数为1mol | |
| C. | 放电时,电解质溶液的pH逐渐增大 | |
| D. | 放电时,负极反应为:CH3OH-6e-+8OH-=CO32-+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变红色;反复数次,试管中的液体出现刺激性气味,表明乙醇已被铜氧化为乙醛 | |
| B. | 向无水乙醇中加入浓H2SO4,加热至170°C产生的气体通入酸性KMnO4溶液,红色褪去,证明生成的气体全部是乙烯 | |
| C. | 将灼烧后的海带灰加水煮沸2-3分钟的目的是加快碘化物在水中的溶解,使灰烬中的碘离子尽可能多的进入溶液 | |
| D. | 海带中提取碘,可将灰化后的海带加水煮沸一段时间后过滤,在滤液中加入稀硫酸后转移到分液漏斗中用CCl4萃取分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
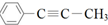 的描述正确的是( )
的描述正确的是( )| A. | 该有机物中只含有非极性键 | |
| B. | 该有机物与溴水的加成产物只有1种 | |
| C. | 该分子中最多有10个原子共平面 | |
| D. | 该分子中最多有5个碳原子共直线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
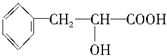
 (只要求写出一个化学方程式,有机物写结构简式).
(只要求写出一个化学方程式,有机物写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com