
���� A��B��W��D��EΪ������Ԫ�أ���ԭ��������������A��W���γ�����Һ̬������A2W��A2W2����Һ̬������ֱ�ΪH2O��H2O2����AΪHԪ�أ�WΪOԪ�أ�A��Dͬ���壬��DΪNaԪ�أ�EԪ�ص���������������������ȣ���E��ԭ���������ӦΪ�������ڢ�A��Ԫ�أ���EΪAlԪ�أ�A��B��W��D��E��Ԫ��������֮��Ϊ39����B��ԭ������Ϊx������1+x+8+11+13=39��x=6������BΪCԪ�أ��ݴ˽��
��� �⣺A��B��W��D��EΪ������Ԫ�أ���ԭ��������������A��W���γ�����Һ̬������A2W��A2W2����Һ̬������ֱ�ΪH2O��H2O2����AΪHԪ�أ�WΪOԪ�أ�A��Dͬ���壬��DΪNaԪ�أ�EԪ�ص���������������������ȣ���E��ԭ���������ӦΪ�������ڢ�A��Ԫ�أ���EΪAlԪ�أ�A��B��W��D��E��Ԫ��������֮��Ϊ39����B��ԭ������Ϊx������1+x+8+11+13=39��x=6������BΪCԪ�أ�
��1��EΪAlԪ�أ�ԭ������Ϊ13��ԭ�Ӻ�����3�����Ӳ㣬��������Ϊ3��λ�����ڱ��������ڵڢ�A�壬
�ʴ�Ϊ���������ڵڢ�A�壻
��2����H��C��O����Ԫ����ɵ�18��������������ֻ�ܺ���1��Cԭ�ӡ�1��Oԭ�ӣ��ʺ���Hԭ����Ŀ=18-6-8=4���ʸ����ṹ��ʽΪCH3OH��
�ʴ�Ϊ��CH3OH��
��3��A2W2ΪH2O2���Ƕ�Ԫ���ᣬ�Ե�һ������Ϊ��������뷽��ʽΪH2O2?HO2-+H+�����ᴦ��BaO2���Ʊ�H2O2������BaSO4���ɣ���Ӧ�Ļ�ѧ����ʽΪBaO2+H2SO4=BaSO4��+H2O2��
�ʴ�Ϊ��H2O2?HO2-+H+��BaO2+H2SO4=BaSO4��+H2O2��
��4��Cu��ϡ�����Ӧ��������������Ե�H2O2������������ͭ��ˮ����Ӧ�����ӷ���ʽΪCu+2H++H2O2=Cu2++2H2O��
�ʴ�Ϊ��Cu+2H++H2O2=Cu2++2H2O��
��5��NaH+H2O=NaOH+H2��
1mol 1mol 1mol
2NaOH+2Al+2H2O=2NaAlO2+3H2��
1mol 1mol 1.5mol
n��H2��=1mol+1.5mol=2.5mol��
V��H2��=2.5mol��22.4L/mol=56L��
�ʴ�Ϊ��56��
���� ���⿼��Ԫ�ص��ƶϺ�Ԫ�ػ�����֪ʶ���Ѷ��еȣ�������Ԫ�ػ�����Ŀ��飬��5���йؼ�����ȷNaH��ˮ�ķ�Ӧ�������÷���ʽ������


 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
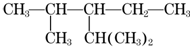 �����л���ϵͳ������2��4-����-3-�һ����飬1mol������ȫȼ������������14mol������һ��ȡ������7�֣�
�����л���ϵͳ������2��4-����-3-�һ����飬1mol������ȫȼ������������14mol������һ��ȡ������7�֣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
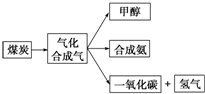 ��1����ͼ��ijú������ҵ����һ���֣�
��1����ͼ��ijú������ҵ����һ���֣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
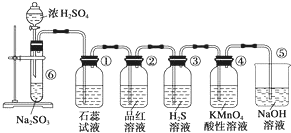 ͼ��ʵ������ȡSO2����֤SO2��ijЩ���ʵ�װ�ã��Իش�
ͼ��ʵ������ȡSO2����֤SO2��ijЩ���ʵ�װ�ã��Իش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2CO3��H2SiO3��HClO���������� | B�� | Na2O��MgO��Al2O3�����ڼ��������� | ||
| C�� | ʯӢ����������������� | D�� | ��ʯ�ҡ����졢ˮ����ڻ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ԭ����Ŀ֮���� 5��4 | B�� | ��ԭ�ӵ����ʵ���֮��Ϊ 3��2 | ||
| C�� | ��Ԫ�ص�����֮��Ϊ 6��5 | D�� | ��Ԫ�ص�����֮��Ϊ 4��5 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com