
| A. | 周期表中金属与非金属的分界线附近可以找到半导体 | |
| B. | 周期表中F是最活泼的非金属,Li是最活泼的金属 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共18个纵行 | |
| D. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
分析 A、根据周期表的结构分析;
B、同主族从上到下金属的活泼性依次增强,同周期从左到右非金属的活泼性增强;
C、Ⅷ族占3个纵行;
D、阳离子:质子数=核外电子数+带电荷数.
解答 解:A、元素周期表中,在金属与非金属的分界线附近的元素既有金属的性质有非金属的性质,能作半导体材料,故A正确;
B、最活泼的金属是Cs,最活泼的非金属是F,故B错误;
C、元素周期表共有18纵行其中7个主族,7个副族,1个0族,1个Ⅷ族,一个Ⅷ族占三个纵行,共18个纵行,故C正确;
D、X2+的核外电子数目为18,依据阳离子:质子数=核外电子数+带电荷数,所以X原子的质子数=18+2=20,为钙元素,在第四周期第ⅡA族,故D正确;
故选:B.
点评 本题考查了元素性质递变规律和元素周期表结构,明确元素周期表排布规律和元素周期律是解题关键,题目难度不大.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入用盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| D | 向少量某物质的稀溶液中滴加稀盐酸,产生了能使澄清石灰水变浑浊的气体 | 该物质一定是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
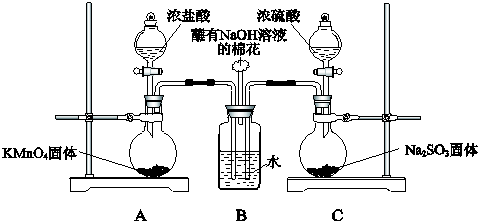
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子电子层数比B原子电子层数多 | |
| C. | 1mol A从酸中置换 H+生成的H2比 1mol B从酸中置换H+生成的H2多 | |
| D. | A金属可以把B金属从其盐溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
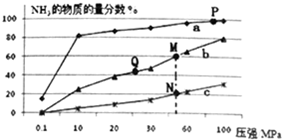 已知N2(g)+3H2(g)?2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图.
已知N2(g)+3H2(g)?2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | b点对应的溶液中:H+、Al3+、NO3-、Cl- | |
| C. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Cl-、NO3-、Fe2+、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com