
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=﹣99 kJ mol-1。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=﹣99 kJ mol-1。
请回答下列问题:
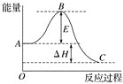
(1) 图中ΔH=___kJ mol-1。
(2) 如果反应速率υ(SO2)为0.05 molL-1min-1,则υ(O2)=___ molL-1min-1、υ(SO3)=____ molL-1min-1;
(3) 已知单质硫的燃烧热为296 kJ mol-1,计算由S(s)生成3 mol SO3(g)的ΔH=___kJ mol-1
【答案】-198 0.025 0.05 -1185
【解析】
(1) 图中为2mol SO2(g)参与反应时的焓变;
(2)化学反应速率之比等于化学计量数之比;
(3) 根据单质硫的燃烧热为296 kJ mol-1,及2SO2(g)+O2(g)![]() 2SO3(g)的焓变进行计算。
2SO3(g)的焓变进行计算。
(1) 图中为2mol SO2(g)参与反应时的焓变,则ΔH=﹣99kJ/mol×2=-198 kJmol-1;
(2)化学反应速率之比等于化学计量数之比,υ(SO2):υ(O2)=2:1,则υ(O2)=0.025molL-1min-1;υ(SO2):υ(SO3)=1:1,则υ(SO3)=0.05 mol L-1min-1;
(3) 已知单质硫的燃烧热为296 kJ mol-1,则S(s)+O2(g)=SO2(g)H=-296 kJ mol-1,2SO2(g)+O2(g)![]() 2SO3(g)H=-198 kJmol-1;生成3mol SO3(g)时,需要3molS(s)反应生成3mol SO2(g),则ΔH=-296kJ/mol×3-198kJ/mol×1.5=-1185 kJmol-1。
2SO3(g)H=-198 kJmol-1;生成3mol SO3(g)时,需要3molS(s)反应生成3mol SO2(g),则ΔH=-296kJ/mol×3-198kJ/mol×1.5=-1185 kJmol-1。


科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是

A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成聚丙烯腈纤维的方法很多,如以乙炔为原料,其合成过程的化学反应方程式
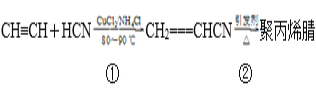
(1)反应①的反应类型为__________________________。
(2)写出反应②的化学方程式:_________________________________。
(3)1mol合成聚丙烯腈的单体在一定条件下最多能与________molH2加成。
(4)CH2=CHCN在一定条件下可与苯乙烯(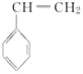 )反应得到一种优良的塑料,该塑料的结构简式为_________________________________。
)反应得到一种优良的塑料,该塑料的结构简式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH溶液吸收烟气中的SO2,将所得的吸收液用三室膜电解技术处理,原理如图所示.下列说法错误的是
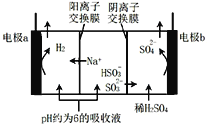
A.电极a为电解池阴极
B.阳极上有反应HSO3—-2e—+H2O=SO42—+3H+发生
C.当电路中通过1mol电子的电量时,理论上将产生0.5mol H2
D.处理后可得到较浓的H2SO4和NaHSO3产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,醢藏着丰富的化学元素,如氯、溴、碘等,海洋资源的综合利用具有非常广阔的前景。
(1)下列说法正确的是_________。
a.AgCl、AgBr、AgI的颜色依次变深 b.F、Cl、Br、I的非金属性依次增强
c.HF、HCl、HBr、HI的还原性的依次增强 d.F2、Cl2、Br2、I2与H2化合由难变易
(2)实验室从海藻灰中提取少量碘的流程如下图:
![]()
①氧化时,可以加入MnO2在酸性条件下进行氧化,反应的离子方程式为:_________。
②上述步骤①②③分离操作分别为过滤、_________、_________。
(3)从海水提取的粗盐中含有Mg2+、Fe2+、Ca2+和SO42—等杂质,“除杂”所需试剂有:①过量的NaOH溶液②过量的Na2CO3溶液③适量的盐酸④过量的BaCl2溶液.试剂的添加顺序为_________。
为使Ca2+完全沉淀,溶液中c(CO32—)应不小于_________mol/L。[已知Ksp(CaCO3)=2.9×10-9,离子浓度小于1×10-5mol/L视为完全沉淀]
(4)目前,利用食盐制取纯碱主要有“氨碱法”和“联合制碱法”两种工艺
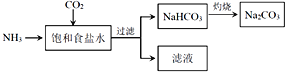
①能析出 NaHCO3的原因是_________。
②“氨碱法”是在滤液中加入_________产生NH3,循环使用,但产生大量的度弃物CaCl2;“联合制碱法“是在滤液中继续通入NH3,并加入NaCl粉末以制得更多的副产物_________。
③常温下,向饱和食盐水中通入NH3和CO2,当(HCO3—)=c(NH4+)时,溶液的pH_____7 (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,硫化物的沉淀在溶液中达溶解平衡时,金属阳离子的浓度随S2-浓度的变化曲线如图所示。据图判断,下列说法错误的是 ( )
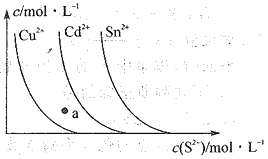
A.三种物质的溶度积大小为Ksp(CuS)<Ksp(CdS)<Ksp(SnS)
B.向SnS悬浊液中加入少量CuSO4固体,c(Sn2+)会减少
C.a点无CdS沉淀产生
D.向含等物质的量浓度的Cu2+、Sn2-的混合液中,滴加Na2S溶液,先析出CuS沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2+3H2![]() 2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为5 mol/L,3 min后测得NH3浓度为0.6 mol/L,则此时间内,下列反应速率表示正确的是
2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为5 mol/L,3 min后测得NH3浓度为0.6 mol/L,则此时间内,下列反应速率表示正确的是
A.v(NH3)=0.1mol/(L·s)B.v(N2)=1.0mol/(L·min)
C.v(H2)=1.67mol/(L·min)D.v(H2)=0.3mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属与硝酸的反应,实验如下。
实验 (20C) | 现象 |
Ⅰ | 无色气体(遇空气变红棕色),溶液变为蓝色 |
Ⅱ | 6mL无色气体(经检测为H2),溶液几乎无色 |
⑴Ⅰ中产生的无色气体是______。
⑵研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于NO3-,所以NO3-没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是______。
![]() 乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
![]() 补全Ⅱ中NO3-被还原为
补全Ⅱ中NO3-被还原为![]() 的过程:NO3- + ______e- + ______= NH4+ + ______H2O
的过程:NO3- + ______e- + ______= NH4+ + ______H2O
⑶研究影响产生H2的因素
实验 | 现象 |
Ⅲ | 3.4m L气体(经检测为H2),溶液略带黄色 |
Ⅳ | 2.6m L气体(经检测为H2),黄色溶液 |
Ⅴ | 无色气体(遇空气变红棕色),深棕色溶液 |
资料:Fe[(NO)]2+在溶液中呈棕色。 ④对比Ⅱ、Ⅲ、Ⅳ,温度不同时收集到氢气的体积不同,原因是______。 ⑤Ⅴ中无色气体是混合气体,则一定含有遇空气变红棕色的气体和______。 ⑷根据实验,金属与硝酸反应时,影响硝酸的还原产物不同的因素有______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com