
【题目】(1)分别写出由氧在一定条件下生成下列物质的化学方程式(必须注明反应条件)。
①Na2O2_______________。
②Na2O__________________。
(2)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式:_____________________。
(3)活泼金属复杂的氧化物(如过氧化物、超氧化物等)在一定条件下都可以生成氧气,从而用作特殊情况下的氧气源。现有下列四种物质,你认为在运输鱼苗的时候用(________)作为氧气源更合适?理由是:_________ 。
A.Na2O2 B.K2O2 C.KO2 D.CaO2
【答案】2Na+O2![]() Na2O2 4Na+O2═2Na2O 4KO2+2CO2=2K2CO3+3O2 D CaO2与水反应生成的Ca(OH)2溶解度小,对水的pH影响小,比较适合鱼苗存活
Na2O2 4Na+O2═2Na2O 4KO2+2CO2=2K2CO3+3O2 D CaO2与水反应生成的Ca(OH)2溶解度小,对水的pH影响小,比较适合鱼苗存活
【解析】
(1)钠与氧气在常温下生成氧化钠,在氧气中点燃反应生成过氧化钠,据此书写方程式;
(2)KO2能吸收CO2生成K2CO3和O2,根据反应物和生成物及反应条件书写方程式;
(3)CaO2与水反应生成的Ca(OH)2溶解度小,对水的pH影响小,比较适合鱼苗存活。
(1)①钠与氧气在空气中点燃反应生成过氧化钠,化学方程式:2Na+O2![]() Na2O2,故答案为:2Na+O2
Na2O2,故答案为:2Na+O2![]() Na2O2;
Na2O2;
②钠与氧气在常温下生成氧化钠,化学方程式:4Na+O2═2Na2O,故答案为:4Na+O2═2Na2O;
(2)KO2能吸收CO2生成K2CO3和O2,根据反应物和生成物及反应条件知,该反应方程式为4KO2+2CO2=2K2CO3+3O2,故答案为:4KO2+2CO2=2K2CO3+3O2;
(3)在运输鱼苗的时候用 CaO2作为氧气源更合适,故选D, CaO2与水反应生成的Ca(OH)2溶解度小,对水的pH影响小,比较适合鱼苗存活,故答案为:D;CaO2与水反应生成的Ca(OH)2溶解度小,对水的pH影响小,比较适合鱼苗存活。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热、遇酸均易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
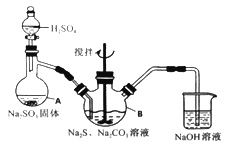
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
……
(1)写出仪器A的名称_______。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH <7,请用离子方程式解释原因_________。
(3)写出三颈烧瓶B中制取Na2S2O3,反应的总化学反应方程式________。
(4)从上述生成物混合液中获得较高产率Na2S2O3·5H2O的步骤为
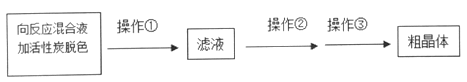
为减少产品的损失,操作①为趁热过滤,“趁热”的原因是______;操作②是______;操作①是抽滤、洗涤、干燥。
(5)测定产品纯度
取6.00g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.500mol/LI2的标准溶液进行滴定,反应原理为2S2O32-+I2=S4O62-+2I-。相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.98 | 22.50 | 20.02 |
滴定时,达到滴定终点的现象是___________。产品的纯度为____________。
(6)Na2S2O3常用作脱氧剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学探究小组拟用铜片制取Cu(NO3) 2,并探究其化学性质。
I.他们先把铜粉放在空气中灼烧,再与稀HNO3反应制取硝酸铜。
(1)如果直接用铜屑与稀HNO3反应来制取硝酸铜,可能导致的两个不利因素是______。
(2)实验中铜粉应该放在_____(选填“蒸发皿”、“坩埚”或“烧杯”)中灼烧。欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤按顺序分别是___、____、过滤。
II.为了探究Cu(NO3)2的热稳定性,探究小组按下图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)

往左试管中放入研细的无水Cu(NO3)2晶体并加热,观察到左试管中有红棕色气体生成,最终残留黑色粉末;用U型管除去红棕色气体,在右试管中收集到无色气体。
(1)红棕色气体是____。
(2)当导管口不再有气泡冒出时,停止反应,这时在操作上应注意________。
(3)探究小组判断Cu(NO3)2的分解属于氧化还原反应,产物除了红棕色气休和黑色固体外,进一步分析、推断,分解产物中一定还含有_____。
III.为了探究Cu(NO3)2在酸性条件下跟铁单质的反应。他们取一支试管,加入Cu(NO3)2溶液,滴入适量稀硫酸酸化,再加入一定量铁粉,实验后没有固体残留物质。该探究小组对反应后溶液中铁元素的价态进行探究,他们设计了实验方案,并进行实验。请在下面表格中补充写出实验操作步骤、预期现象与结论___、___、___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出符合下列条件的原子的元素符号并画出其原子结构示意图。
①核外有2个电子层、10个电子的原子__________________;
②质量数为23、中子数为12的原子__________________;
③电子总数是最外层电子数3倍的原子__________________。
(2)用下列原子或离子的结构示意图的编号(A、B、C、D)填空:
A.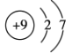 B.
B. C.
C. D.
D.
①电子层排布相同的是__________________;
②属于同一种元素的是__________________;
③属于金属元素的是__________________;
④属于稀有气体元素的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药)。因为具有潜在致癌性,已被禁止用作鱼药,下列关于无色孔雀石绿的叙述中,正确的是( )
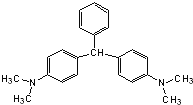
A.分子中所有的碳原子可能在同一平面上
B.无色孔雀石绿与氢气完全加成后的产物的核磁共振氢谱中有7个峰
C.无色孔雀石绿可与溴水中的溴发生加成反应
D.在一定条件下,1mol无色孔雀石绿可以和9mol氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 2NO(g)+O2(g)2NO2(g) H<0,若该反应在绝热、恒容的密闭体系中进行,则下列示意图能说明在t1时刻达到平衡状态的是 ( )
a. 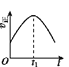 b.
b.  c.
c. 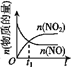 d.
d. 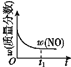
A.abB.bcC.bdD.cd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漆酚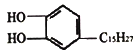 是生漆的主要成分,能溶于有机溶剂中,生漆涂在物体表面,能在空气中干燥转变为黑色漆膜从而起到保护层的作用,下列说法错误的是
是生漆的主要成分,能溶于有机溶剂中,生漆涂在物体表面,能在空气中干燥转变为黑色漆膜从而起到保护层的作用,下列说法错误的是
A. 可以燃烧,当氧气充分时,产物为CO2和H2O
B. 与FeCl3溶液发生显色反应
C. 能发生取代反应和加成反应
D. 不能被酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国拥有丰富的稀土矿产资源,在合金中加入适量的稀土金属,能大大改善合金的性能,因而,稀土金属又被称为冶金工业的维生素。铈是一种重要的稀土元素,常见的化合价为+3和+4。某课题小组以平板电视显示屏生产过程中,产生的大量废玻璃粉末为原料(其中含有SiO2、Fe2O3、CeO2、FeO等物质),制取CeO2和硫酸铁铵矾[NH4Fe(SO4)212H2O],流程如下:

已知:CeO2不溶于强酸或强碱
(1)稀酸A中酸的分子式是___。滤渣2的主要成分___。(填化学式)
(2)滤液1中加入H2O2溶液的目的是___。滤渣1中加入H2O2,主要利用了H2O2的什么性质?___。
(3)酸性条件下,H2O2、Fe3+、CeO2三种物质,氧化性由强到弱的顺序是___。
(4)写出由滤液2生成Ce(OH)4的离子方程式___。
(5)硫酸铁铵矾[NH4Fe(SO4)212H2O]广泛用于水的净化处理,其净水原理是___(用离子方程式表示)。
(6)取上述流程中所获得的Ce(OH)4样品5.31g,加稀H2SO4溶解后配制成100mL溶液,取出10.00mL,用浓度为0.1000 molL-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mL标准溶液。该样品中Ce(OH)4的纯度是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是___________,其外围电子排布式为___________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是___________。
(3)配位化学创始人维尔纳发现,取1mol配合物CoCl3·6NH3(黄色)溶于水,加人足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
①根据上述事实推测原配合物中络离子化学式为___________。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式___________;生成气体分子的中心原子杂化方式为___________。
(4)经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于___________,若该堆积方式下的晶胞参数为acm,则钴原子的半径为___________pm。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com