
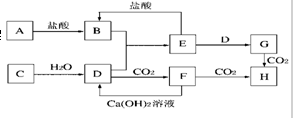
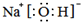 ,故答案为:
,故答案为: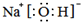 ;
;
| ||
| ||


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
| A、假如为平面四边形,则有两种同分异构体; |
| B、假如为四面体,则有二种同分异构体; |
| C、假如为平面四边形,则无同分异构体 |
| D、假如为四面体,则无同分异构体. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同质量的Na2CO3和NaHCO3分别与足量的盐酸反应,在相同条件下Na2CO3产生的CO2体积大 |
| B、将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3溶液中产生沉淀 |
| C、向Na2CO3饱和溶液中通入足量的CO2会有NaHCO3晶体析出 |
| D、Na2CO3中含少量NaHCO3,可用加热法除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 事 实 | 结 论 | |
| A | 某分散系具有丁达尔效应 | 该分散系是胶体 |
| B | 某溶液中加入BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
| C | 将氯气通入溴化钠溶液中有溴单质生成 | 氧化性:Cl2>Br2 |
| D | 加热时,铜能与浓硝酸反应 | 浓硝酸有强氧化性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L0.1mol?L-1(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
| B、25℃时,等体积、等浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
| C、25℃时,BaCO3饱和溶液(Ksp=8.1×10-9):c(Ba2+)=c(CO32-)>c(H+)=c(OH-) |
| D、1.0 mol?L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SiO3胶体和NaCl溶液 |
| B、FeCl3溶液和Fe(OH)3胶体 |
| C、豆浆和蔗糖溶液 |
| D、CuSO4溶液和Na2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com