
【题目】碲(Te)及其化合物有许多优良性能,被广泛用于冶金、化工等领域。
(1)碲(Te)在周期表中的位置为________________________。碲化氢的还原性比H2S的还原性__________(填“强”或“弱”)。
(2)已知25℃时,亚碲酸(H2TeO3)的电离平衡常数:Ka1=1×10—3,Ka2=2×10—8。
①0.1mol/L H2TeO3溶液中H2TeO3的电离度约为__________;
②已知NaHTeO3的水溶液呈酸性,溶液中所有离子浓度大小顺序为____________________。
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含Cu2Te,还含少量Ag、Au)为原料制备单质碲,其工艺流程如图:
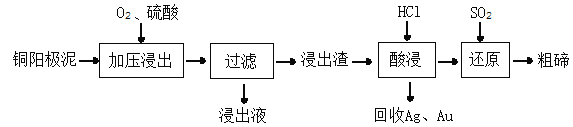
①已知浸出渣的主要成分是TeO2。写出“加压浸出”过程中的离子方程式________________________,该过程中,应控制溶液的pH为4.5~5.0,酸性不能太强的原因是__________________________。
②“酸浸”后将SO2通入浸出液即可制得单质碲,写出生成单质碲的化学方程式______________________。
③工业上还可以将铜阳极泥煅烧生成TeO2,然后碱浸,过滤,再对滤液进行电解的方法得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为_______________________。
【答案】 第五周期第ⅥA族 强 10% c(Na+)>c(HTeO3—)>c(H+)>c(TeO32—)>c(OH—) Cu2Te+2O2+4H+=TeO2+2Cu2++2H2O TeO2会与酸反应导致Te元素损失 TeCl4+2SO2+4H2O=Te↓+4HCl+2H2SO4 TeO32—+4e—+3H2O=Te+6OH—
【解析】(1). 碲是52号元素,位于元素周期表的第五周期第ⅥA族,碲和硫元素位于同一主族,碲元素的非金属性小于硫,所以碲化氢的还原性比H2S的还原性强,故答案为:第五周期第ⅥA族;强;
(2). ①.亚碲酸(H2TeO3)是二元弱酸,0.1mol/L H2TeO3的电离度可以依据第一步电离计算,亚碲酸(H2TeO3)的Ka1=1×103,第一步电离方程式为:H2TeO3H++HTeO3,设c(H+)=xmol/L,则Ka1=![]() =
=![]() =1×103,解得x≈0.01mol/L,则H2TeO3的电离度为:
=1×103,解得x≈0.01mol/L,则H2TeO3的电离度为:![]() ×100%=10%,故答案为:10%;
×100%=10%,故答案为:10%;
②. HTeO3既可以水解也可以电离,则c(Na+)>c(HTeO3-),已知NaHTeO3的水溶液呈酸性,说明HTeO3的电离程度大于水解程度,则c(HTeO3-)>c(H+)>c(TeO32-)>c(OH-),溶液中所有离子浓度大小顺序为:c(Na+)>c(HTeO3-)>c(H+)>c(TeO32-)>c(OH-),故答案为:c(Na+)>c(HTeO3-)>c(H+)>c(TeO32-)>c(OH-);
(3).①.TeO2微溶于水,易溶于较浓的强酸和强碱,说明TeO2是两性氧化物,“加压浸出”过程中Cu2Te被氧气氧化生成铜离子和TeO2,离子方程式为:Cu2Te+2O2+4H+=TeO2+2Cu2++2H2O,因为TeO2是两性氧化物,若H2SO4过量造成溶液酸性太强,会导致TeO2继续与H2SO4反应导致损失,故答案为:Cu2Te+2O2+4H+=TeO2+2Cu2++2H2O;TeO2会与酸反应导致Te元素损失;
②. SO2将TeCl4还原为Te,自身被氧化为硫酸,根据得失电子守恒和原子守恒,该反应的化学方程式为:TeCl4+2SO2+4H2O=Te↓+4HCl+2H2SO4,故答案为:TeCl4+2SO2+4H2O=Te↓+4HCl+2H2SO4;
③. 将铜阳极泥煅烧生成TeO2,然后碱浸,过滤,所得滤液是Na2TeO3的溶液,用惰性电极电解溶液,在阴极上TeO32-得到电子生成Te,电极反应式为:TeO32-+4e-+3H2O=Te+6OH-,故答案为:TeO32-+4e-+3H2O=Te+6OH-。


科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实 验 步 骤 | 解 释 或 实 验 结 论 |
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的相对分子质量为:________。 |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:______________。 |
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团:_______________________。 |
(4)A的核磁共振氢谱如下图:
| (4)A中含有________种氢原子。 |
(5)综上所述,A的结构简式_____________。 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质“反应程度”的说法正确的是( )
A.一定条件下,2molSO2与足量O2反应可得到2molSO3
B.含4mol HCl的浓盐酸与足量的MnO2加热反应可制备1mol Cl2
C.10mL 18.0mol/L H2SO4与足量铜加热反应可制备0.09molSO2
D.一定条件下,1mol N2与3mol H2反应可制备1.0mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)![]() 2Z(g) H< 0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
2Z(g) H< 0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
A.升高温度,X的物质的量减小
B.增大压强(缩小容器体积),Z的浓度不变
C.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D.保持容器体积不变,充入一定量的Z,重新平衡时,Y的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定的四种溶液中加入以下各种离子,能在原溶液中大量共存的是
A. 常温下pH=1 的溶液: K+、HCO3-、Br、Ba2+
B. 滴加酚酞溶液显红色的溶液:Fe3+、NH4+、Cl、NO3-
C. 所含溶质为FeCl3的溶液:K+、SO42-、NO3-、H+
D. 强碱性溶液:Cu2+、Na+、Mg2+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量的说法正确的是
A. 中和反应是吸热反应 B. 燃烧属于放热反应
C. 化学键断裂放出能量 D. 反应物总能量与生成物总能量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
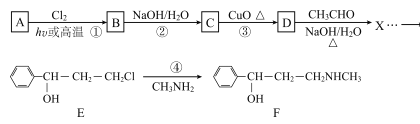
【题目】合成神经抑制剂F的一种路线如图所示:
已知:![]()
请回答下列问题:
(1)已知芳香烃A的相对分子质量为92,A的结构简式为____;B的系统命名是___ ;C中含氧官能团的名称是____。
(2)反应③的化学反应方程式为____;①~④中属于取代反应的是____。
(3)D分子中最多有____个原子共平面。
(4)④的反应中,因反应温度控制不当,常常有副产物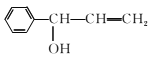 生成,写出可能的副反应方程式____。
生成,写出可能的副反应方程式____。
(5)包含C在内,C的同分异构体中芳香族化合物共有____种,其中满足下列条件同分异构体的结构简式为____。
①能使FeCl3溶液显色,②核磁共振氢谱上有4组峰,且峰面积之比为3:2:2:1。
(6)已知-CHO与RNH2易发生反应,现以中间体X为原料,设计出制备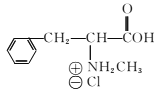 的合成路线(无机试剂自选):________________________________________
的合成路线(无机试剂自选):________________________________________
流程示例:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com