
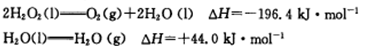


科目:高中化学 来源:不详 题型:单选题
| A.3He和3H互为同位素 | B.3He原子核内质子数为3 |
| C.3He原子核内中子数为1 | D.3He原子易失去两个电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.次氯酸的酸性比硫酸弱 |
| B.氯气能置换氢硫酸(H2S的水溶液)中的硫 |
| C.氢硫酸是弱酸,而盐酸是强酸 |
| D.硫在常温下为固态,而氯气为气态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.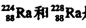 是中子数不同质子数相同的同种核素 是中子数不同质子数相同的同种核素 |
| B.第IA族金属元素是同周期中金属性最强的元素 |
| C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
| D.短周期元素形成离子后,最外层都达到8电子稳定结构 |
查看答案和解析>>
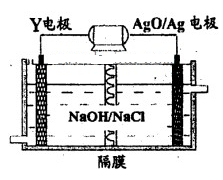
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| X | X的基态原子核外只有三个能级,且各能级电子数相等 |
| Y | Y的基态原子最外层电子数是其内层电子总数的2.5倍 |
| Z | Z的基态价电子结构为nsn-1 |
| W | W单质常在火山口附近被发现,其氧化物是造成酸雨的主要原因之一 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
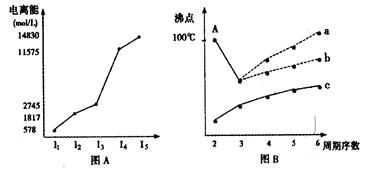
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2A(g) △H =-92.4 kJ?mol―1
2A(g) △H =-92.4 kJ?mol―1 | 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0 min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com