
| A. | X>Y>Z | B. | Y>X>Z | C. | Z>X>Y | D. | Z>Y>X |
分析 X、Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素阳离子半径,利用原子序数越大,离子半径越小来分析原子序数的关系;再Z和Y两元素的原子最外层电子数相同,则在同一主族,Z元素的原子半径大于Y元素的原子半径,利用同主族原子半径越大,原子序数越大来解答.
解答 解:X、Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素阳离子半径,
由原子序数越大,离子半径越小,
则原子序数为Y>X,
又Z和Y两元素的原子最外层电子数相同,则在同一主族,Z元素的原子半径大于Y元素的原子半径,
由同主族原子半径越大,原子序数越大,
则原子序数为Z>Y,
所以X、Y、Z三种元素原子序数为Z>Y>X,
故选D.
点评 本题考查原子序数的关系,为高频考点,侧重于学生的分析能力的考查,明确元素在周期表中的位置及微粒半径与原子序数的关系是解答本题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 元素的最高正化合价为+6 | |
| B. | 元素原子的最外层只有一个电子 | |
| C. | 原子核外各电子层的电子数均达到饱和 | |
| D. | 其最高价氧化物溶于水是强酸,且有气态氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | E | F | G | R | ||||
| 3 | B | C | D | H |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| a | b | c | d | |
| n(A)/mol | 2.0 | 1.2 | 2 | 3.6 |
| n(B)/mol | 1.2 | 0.4 | 1 | 1.5 |
| n(c)/mol | 0.1 | 0 | 0.5 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 I氮是地球上极为丰富的元素,氮及其化合物与人们的生活息息相关.在氮的单质和常见化合物中:
I氮是地球上极为丰富的元素,氮及其化合物与人们的生活息息相关.在氮的单质和常见化合物中: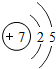 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物A常用于食品行业.已知9.0gA在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.
有机物A常用于食品行业.已知9.0gA在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com