(2011?开封一模)“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义.请你回答以下问题:
(1)无机非金属材料.高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”.这种材料可以按下列方法制备:
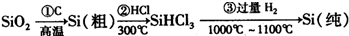
①写出步骤①的化学方程式
.
②步骤②经过冷凝得到的SiHCl
3(沸点33.0℃)中含有少量的SiCl
4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl
3的主要化学操作的名称是
蒸馏(或分馏)
蒸馏(或分馏)
.
③请写出二氧化硅与氢氟酸反应的化学方程式
SiO2+4HF=SiF4↑+2H2O
SiO2+4HF=SiF4↑+2H2O
.
(2)磁性材料.这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施着对它的防护.最常见的铁制品腐蚀就是电化学腐蚀,请出最为普遍的电化学腐蚀的负极反应式
Fe→Fe2++2e-
Fe→Fe2++2e-
.
(3)激光材料.我国是激光技术先进的国家,红宝石(Al
2O
3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明:
Al2O3+6H+═2Al3++3H2O
Al2O3+6H+═2Al3++3H2O
,
Al2O3+2OH-+3H2O=2[Al(OH)4]-
Al2O3+2OH-+3H2O=2[Al(OH)4]-
.
(4)纳米材料.胶体是一种物质以“纳米”颗粒的形式分散到另一种物质里形成的分散系,胶体粒子的直经大约是
1nm~100nm
1nm~100nm
,三氯化铁溶液可以加速伤口止血,请简述原因
氯化铁是电解质,使血液胶体聚沉
氯化铁是电解质,使血液胶体聚沉
.
(5)高分子材料.可以分成无机高分子材料和有机高分子材料.一种新型高效净水剂
[AlFe(OH)
nCl
6-n]
m就属于无机高分子材料,广泛应用于生活用水和工业污水处理,其中铁元素的化合价为
+3
+3
.
一种合成纤维腈纶,又称“人造羊毛”,由丙烯腈(CH
2=CH-CN)为原料聚合生成,请写出生成该有机高分子材料的化学方程式
.

 名校课堂系列答案
名校课堂系列答案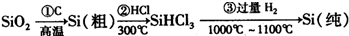


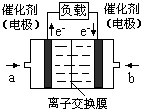 氧气”),b处电极上发生的电极反应是:
氧气”),b处电极上发生的电极反应是: