
| A. | 两种气体的分子个数之比为17:16 | |
| B. | 同温同压下,两种气体的体积之比为17:16 | |
| C. | 两种气体的氢原子个数之比为17:12 | |
| D. | 同温同压下,两种气体的密度之比为17:16 |
分析 令CH4和NH3的质量都为1g,根据n=$\frac{m}{M}$计算CH4和NH3的物质的量.
A.分子数目之比等于物质的量之比;
B.同温同压下,气体体积之比等于物质的量之比;
C.每个CH4分子含有4个H原子,每个NH3分子含有3个H原子,计算二者含有的H原子的物质的量,据此判断;
D.ρ=$\frac{m}{v}$,相同状况下,等质量的CH4和NH3,密度之比等于体积反比.
解答 解:A.分子数目之比等于物质的量之比,等质量的CH4和NH3分子数之比为$\frac{1}{16}$mol:$\frac{1}{17}$mol=17:16,故A正确;
B.同温同压下,气体体积之比等于物质的量之比,故等质量的CH4和NH3的体积之比为:$\frac{1}{16}$mol:$\frac{1}{17}$mol=17:16,故B正确;
C.每个CH4分子含有4个H原子,1gCH4含有H原子的物质的量为4×$\frac{1}{16}$mol,每个NH3分子含有3个H原子,1gNH3含有H的原子物质的量为3×mol,所以等质量的CH4和NH3含有H原子数目之比为4×$\frac{1}{16}$mol:3×$\frac{1}{17}$mol=17:12,故C正确;
D.同温同压下,气体体积之比等于物质的量之比,等质量的CH4和NH3的体积之比为17:16,密度之比等于体积反比,则两者密度比为16:17,故D错误;
故选D.
点评 本题考查常用化学计量的有关计算、阿伏伽德罗定律及推论,难度不大,注意公式的运用与基础知识的掌握.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 使用催化剂 | C. | 增大H2浓度 | D. | 减小压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
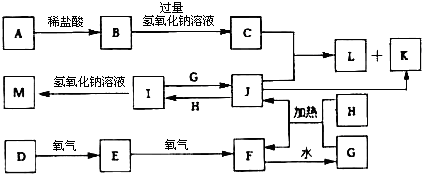
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
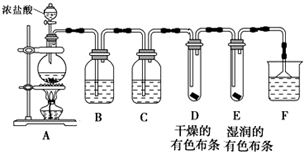
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中滴加2滴①KSCN溶液 | ②两份溶液都变血红色 | 生成物中都有FeCl3 |
| 分别向A、B溶液中滴加几滴KMnO4溶液 | 两份溶液颜色均无明显变化 | 生成物中都不含③FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合体系中气体密度发生变化 | B. | 正、逆反应速率改变 | ||
| C. | 混合物中各组分的浓度改变 | D. | 反应物的转化率改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2 NA? | |
| B. | 常温下,0.l mol碳酸钠晶体中含有CO32- 的个数为0.1NA | |
| C. | 标准状况下,11.2L 18O2中所含中子数为8NA | |
| D. | 25℃时,l L pH=13的Ba(OH)2溶液中含有的OH- 数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 开启啤酒瓶后会大量冒泡 | 压强减小,气体的溶解平衡向压强增大方向移动 |
| B | 废旧电池要集中回收处理 | 废旧电池中含有重金属离子,随意丢弃会污染环境 |
| C | 热碱水清除炊具上残留的油污 | Na2C03和油污可直接发生反应 |
| D | 工业上常用电解法冶炼Na、Mg | 电解池阴极有强还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4b}{5a}$ | B. | $\frac{5a}{11.2b}$ | C. | $\frac{22.4a}{5b}$ | D. | $\frac{11.2b}{5a}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com