
| A. | KAl (SO4)2=K++Al3++2 SO42- | B. | H2CO3=H++HCO3- | ||
| C. | Ca(HCO3)2=Ca2++2H++2CO32- | D. | Ba(OH)2=Ba2++OH2- |
分析 强电解质,完全电离,用等号;弱电解质,部分电离,用可逆号,注意原子团不能拆.
解答 解:A.明矾为强电解质,完全电离,电离方程式:KAl (SO4)2=K++Al3++2 SO42-,故A错误;
B.碳酸为多元弱酸,分步电离,以第一步为主,电离方程式:H2CO3?H++HCO3-,故B错误;
C.碳酸氢钙为强电解质,完全电离,碳酸氢根离子不能拆,电离方程式:Ca(HCO3)2=Ca2++2HCO3-,故C错误;
D.氢氧化钡为强电解质,完全电离,电离方程式:Ba(OH)2=Ba2++2OH-,故D错误;
故选:A.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方程式书写方法是解题关键,注意电离方程式书写应遵循原子个数守恒、电荷守恒规律,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
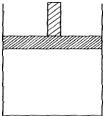 150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4L N2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度.平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5.
150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4L N2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度.平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| $\frac{P}{{P}_{0}}$ | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④ | C. | ①③④ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| B. | 向沸水中滴加饱和FeCl3溶液,持续加热最终能得到Fe(OH)3胶体 | |
| C. | “忽闻海上有仙山,山在虚无缥缈间”描述了一种与胶体有关的自然现象 | |
| D. | 水泥厂、冶金厂常用静电除尘法除去烟尘,利用了胶体带电的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和己烷(溴水) | B. | 乙醛和丙烯酸(KMnO4溶液) | ||
| C. | 矿物油和植物油(NaOH溶液) | D. | 硝基苯和CCl4(水) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com