
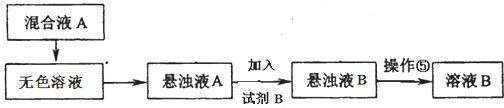
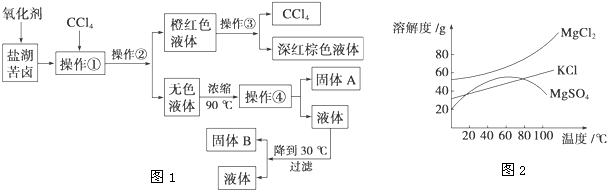
某研究性学习小组拟取盐湖苦卤的浓缩液(富含Ca2+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的无水CaCl2及液溴,他们设计了如下流程:

回答以下问题:
(1)操作Ⅰ中加入的试剂1是 ;在从橙色液体中分离出溴时,可能会导致收集到的产品中混有低沸点杂质的装置(见图A、B、C、D)是 。

(2)加入溶液W的目的是 。
(3)操作Ⅲ所用的仪器除三脚架、酒精灯,还需要 。
(4)某同学用如上图E所示的实验装置制取操作1前的氧化剂,写出该反应的离子方程式 ,试简述该装置气密性的检验方法 。
(1)四氯化碳(或CCl4);CD(2)除去溶液中SO42-; (3)蒸发皿、玻璃棒
(4)MnO2+4H++2Cl- Mn2++2H2O+Cl2↑;
Mn2++2H2O+Cl2↑;
法一:打开弹簧夹,关闭分液漏斗活塞,将导管外接导气管,并将导气管末端插入水槽中,用手握住圆底烧瓶(或用酒精灯对其进行微热),在导气管末端有气泡产生,在松开手(或撤离酒精灯)以后,导气管末端有一段水柱上升且一段时间内不下降,则证明该装置的气密性良好。
法二:关闭弹簧夹,打开分液漏斗的活塞,向烧瓶中不断加水,若一段时间后水不再流下,说明装置气密性良好。
【解析】
试题分析:(1)盐卤中首先加入氯水将溴化物氧化为溴单质,再加入四氯化碳作萃取剂将溴单质从水中萃取出来,再根据液态溴单质沸点与四氯化碳不同,采用蒸馏法进行分离。蒸馏时温度计的水银球应该在支管口附近,若在液面下或位置太低就会收集到低沸点的馏分。
(2)为防止产生硫酸钙沉淀,应先加入氯化钡溶液使硫酸根离子发生反应产生硫酸钡沉淀,来除去硫酸根离子。贝壳的主要成分是碳酸钙,煅烧分解得到氧化钙,将其加入其上层清液中发生反应产生氢氧化钙,镁离子转化成氢氧化镁沉淀,过滤除去,用氯化钙溶液加热蒸发得到氯化钙晶体,在把晶体在氯化氢的氛围中加热蒸干届可制取得到无水氯化钙。操作Ⅲ蒸发所用的仪器除三脚架、酒精灯,还需要蒸发皿、玻璃棒。
(4)氯气在实验室中式用二氧化锰与浓盐酸加热制取的,反应的离子方程式是:MnO2+4H++2Cl- Mn2++2H2O+Cl2↑。检验装置气密性的方法可以是关闭弹簧夹,打开分液漏斗的活塞,向烧瓶中不断加水,若一段时间后水不再流下,说明装置气密性良好。也可采用其他方法。
Mn2++2H2O+Cl2↑。检验装置气密性的方法可以是关闭弹簧夹,打开分液漏斗的活塞,向烧瓶中不断加水,若一段时间后水不再流下,说明装置气密性良好。也可采用其他方法。
考点:考查混合物的分离、装置气密性检查、氯气的制法、杂质的除去等的知识。


科目:高中化学 来源: 题型:阅读理解

| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com