
| A. | 分散质微粒的大小与分散系种类的关系: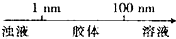 | |
| B. | 常温下溶液的pH其酸碱性的关系: | |
| C. | 硫的化合物中化合价与其氧化性、还原性的关系: | |
| D. | Na与O2反应的产物: |
分析 A、依据分散系的本质区别是分散质微粒直径的大小判断;
B、常温下溶液中存在水的离子积常数,溶液PH=7呈中性,小于7呈酸性,大于7呈碱性;
C、硫元素化合价最低价具有还原性,最高价具有氧化性,中间价态既具有氧化性,也具有还原性;
D.Na与氧气反应的产物与反应条件有关,与反应物的物质的量的多少无关;
解答 解:A、1nm=10-7m,分散质微粒直径小于1nm形成的分散系为溶液,大于100nm形成的为浊液,分散质微粒直径在1nm~100nm时形成的分散系为胶体,故A错误;
B、常温下,溶液PH=7呈中性,小于7呈酸性,大于7呈碱性;故B错误;
C、硫元素化合价最低价具有还原性,最高价具有氧化性,中间价态既具有氧化性,也具有还原性;故C正确;
D.Na与氧气反应的产物与反应条件有关,与反应物的物质的量的多少无关,故D错误;
故选C.
点评 本题考查了常见的用数轴法表示化学知识,完成此题,可以依据已有的知识进行,所以要求同学们在平时的学习中加强基础知识的储备,以便能够灵活应用.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用木材作燃料 | B. | 用柴油替代汽油 | C. | 把煤变成煤气 | D. | 开发风能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 据反应3NO2+H2O═2HNO3+NO可知,NO2是HNO3的酸酐 | |
| B. | 据反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O和3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,可知浓HNO3的氧化性不如稀HNO3强 | |
| C. | 据反应2NO2(g)?N2O4(g)△<0可知要制得较纯净的NO2,需高温、低压环境 | |
| D. | NO2、Br2(g)同为红棕色气体,可用湿润的淀粉-KI试纸鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 己烷的密度比水大,且难溶于水 | B. | 己烷在光照时能发生取代反应 | ||
| C. | 己烷在光照时能发生加成反应 | D. | 己烷不易燃烧,可作为灭火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该未知物X为NaI | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为5:2 | |
| C. | 该反应中,发生氧化反应的过程是KIO3→I2 | |
| D. | 由反应可知还原性强弱顺序为:Na2SO3>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a极为负极,b极为正极 | |
| B. | 放电过程中,a、b电极上均发生氧化还原反应 | |
| C. | 该电池工作时添加甲醇的一极,附近溶液的碱性减弱,反应的离子方程式为:CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 若用此电源电解饱和食盐水,每消耗0.1molO2则阳极理论上生成0.2molCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
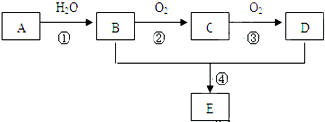
 是重要的化工原料,其合成过程如图:
是重要的化工原料,其合成过程如图:
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com